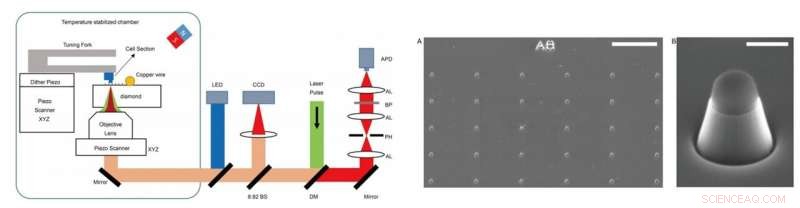
GAUCHE - Installation expérimentale. L'expérience a été réalisée sur une installation faite maison, qui combinait la microscopie par résonance magnétique à détection optique (ODMR) avec la microscopie à force atomique (AFM). DM :miroir dichroïque. BP :filtre passe-bande fonctionnant à 650-775 nm. APD :photodiode à avalanche. CCD :dispositif à couplage de charge. LED :diode électroluminescente de 470 nm. AL :lentille achromatique. PH :sténopé d'une taille de 30 µm. BS :séparateur de faisceau. DROITE - Images des nanopiliers sur les diamants. (A) Imagerie SEM des nanopiliers en diamant fabriqués juste après la gravure ionique réactive (RIE). Le sommet du nanopilier est recouvert d'hydrogène silsesquioxane (HSQ) pour protéger le centre NV. (B) Un seul nanopilier en forme de cylindre trapézoïdal pour détecter les sections cellulaires adhérées à la pointe de l'AFM. Barres d'échelle, 10 µm (A); 400 nm (B). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aau8038.
En sciences de la vie, la capacité de mesurer la distribution des biomolécules à l'intérieur d'une cellule in situ est un objectif de recherche important. Parmi une variété de techniques, les scientifiques ont utilisé l'imagerie magnétique (MI) basée sur le centre de vacance d'azote (NV) dans les diamants comme un outil puissant dans la recherche biomoléculaire. Cependant, L'imagerie à l'échelle nanométrique des protéines intracellulaires est restée un défi jusqu'à présent. Dans une étude récente maintenant publiée dans Avancées scientifiques , Pengfei Wang et ses collègues des départements interdisciplinaires de physique, biomacromolécules, information quantique et sciences de la vie en Chine, utilisé des protéines de ferritine pour démontrer la réalisation MI de protéines endogènes dans une seule cellule, en utilisant le centre de manque d'azote (NV) comme capteur. Ils ont imagé les ferritines intracellulaires et les organites contenant de la ferritine à l'aide de l'IM et de la microscopie électronique corrélative pour ouvrir la voie à l'imagerie magnétique (IM) à l'échelle nanométrique des protéines intracellulaires.
L'augmentation de la résolution spatiale existante de l'imagerie biomédicale est nécessaire pour répondre aux demandes continues en imagerie médicale, et donc, parmi une variété de techniques, l'imagerie magnétique est actuellement d'un grand intérêt. L'imagerie par résonance magnétique (IRM) est largement utilisée pour quantifier la distribution des spins nucléaires, mais l'IRM conventionnelle ne peut atteindre qu'une résolution de 1 µm en imagerie de spin nucléaire où la résolution est limitée par la sensibilité de détection électrique. Les scientifiques ont développé une série de techniques pour briser cette barrière de résolution, comprenant un dispositif d'interférence quantique supraconducteur et une microscopie à force de résonance magnétique. Néanmoins, ces rapports nécessitent un environnement cryogénique et un vide poussé pour l'imagerie, limiter la mise en œuvre expérimentale et sa traduction en pratique clinique.
Une méthode de détection quantique récemment développée basée sur le centre de vacance d'azote dans le diamant a radicalement repoussé les limites des techniques d'IM à l'échelle nanométrique pour détecter des molécules organiques et des protéines en laboratoire. Les scientifiques ont combiné la détection quantique avec les centres NV et la microscopie à sonde à balayage pour démontrer l'IRM à l'échelle nanométrique pour un seul spin électronique et un petit ensemble de spins nucléaires tout en utilisant le centre NV comme magnétomètre biocompatible pour imager de manière non invasive les particules ferromagnétiques dans les cellules à l'échelle subcellulaire (0,4 µm). Par exemple, la dépolarisation du centre NV peut être utilisée comme un magnétomètre à large bande pour détecter et mesurer le bruit fluctuant des ions métalliques et des spins nucléaires. Cependant, une telle imagerie de protéines uniques via MI à l'échelle nanométrique n'a pas été signalée dans la cellule unique jusqu'à présent.
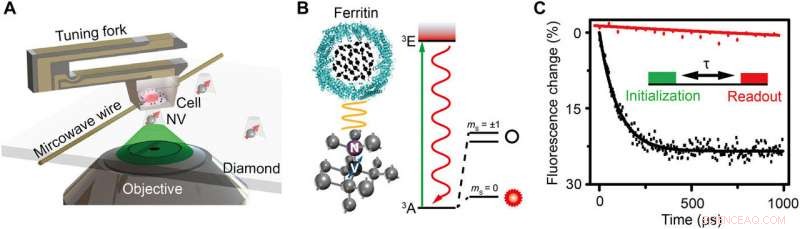
Schéma du montage et principe expérimental. (A) Vue schématique du montage expérimental. La cellule enrobée de résine est fixée à un diapason et balaye au-dessus du nanopilier en diamant qui contient un centre NV peu profond. Un fil de cuivre est utilisé pour fournir l'impulsion micro-ondes au centre NV. Un laser vert (532 nm) du microscope confocal (CFM) est utilisé pour adresser, initialiser, et lire le centre NV. (B) À gauche :Réseau cristallin et niveau d'énergie du centre NV. Le centre NV est un défaut ponctuel constitué d'un atome d'azote de substitution et d'une lacune adjacente dans le diamant. A droite :vue schématique d'une ferritine. Les flèches noires indiquent les spins électroniques de Fe3+. (C) Démonstration expérimentale de la détection de bruit de spin avec et sans ferritine sous forme de décroissance de polarisation pour le même centre NV. L'encart est la séquence d'impulsions pour la détection et l'imagerie de la ferritine. Un laser vert de 5 µs est utilisé pour initialiser l'état de spin à ms =0, suivi d'un temps d'évolution libre pour accumuler le bruit magnétique, et enfin l'état de spin est lu en détectant l'intensité de fluorescence. La séquence d'impulsions est répétée environ 105 fois pour acquérir un bon rapport signal sur bruit (SNR). Le temps de relaxation est ajusté à 0,1 et 3,3 ms par décroissance exponentielle pour le cas avec et sans ferritine, respectivement, indiquant un bruit de rotation de 0,01 mT2. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aau8038.
Dans le travail present, Wang et al. ont rapporté deux avancées techniques pour permettre l'IM à l'échelle nanométrique de protéines intracellulaires dans une seule cellule. Pour ça, ils ont gelé la cellule à un état solide et l'ont segmentée de manière complexe en une forme de cube, puis placé sur une sonde à balayage diapason d'un microscope à force atomique (AFM) pour l'imagerie, où la section transversale plate de la cellule était exposée à l'air. Les scientifiques ont utilisé la configuration de placement de l'échantillon pour permettre au capteur NV d'être positionné à moins de 10 nm des protéines cibles et ont utilisé l'AFM pour supprimer la dérive thermique pendant le positionnement de l'échantillon. Ils ont ensuite conçu des nanopiliers trapézoïdaux en forme de cylindre sur une surface de diamant en vrac pour l'acquisition d'images, raccourcir techniquement le temps d'acquisition des images d'un ordre par rapport aux méthodes précédentes. Dans la présente étude, les scientifiques ont utilisé cette technique pour effectuer un MI in situ du bruit magnétique fluctuant des protéines de ferritine intracellulaire (un biomarqueur des réserves de fer et de la saturation de la transferrine dans le corps) au sein du dispositif expérimental.
La ferritine est un complexe protéique globulaire d'un diamètre extérieur de 12 nm, contenant une cavité de 8 nm de diamètre qui permet de stocker jusqu'à 4 500 atomes de fer dans la protéine. Le bruit magnétique des ions ferriques peut être détecté en raison de leurs effets sur le T
The scientists used the hepatic carcinoma cell line (HepG2) for the experiments and studied iron metabolism by treating the cells with ferric ammonium citrate (FAC), which significantly increased the amount of intracellular ferritin. They verified this using confocal microscopy (CFM), western blotting and TEM techniques at first. The results showed the primary localization of ferritins in the intracellular puncta around the nucleus, among the cytoplasm. The scientists used bulk electron paramagnetic resonance (EPR) spectroscopy to confirm the paramagnetic properties of ferritin in the FAC-treated HepG2 cells and mass spectroscopy to measure the interference due to other paramagnetic metal ions.
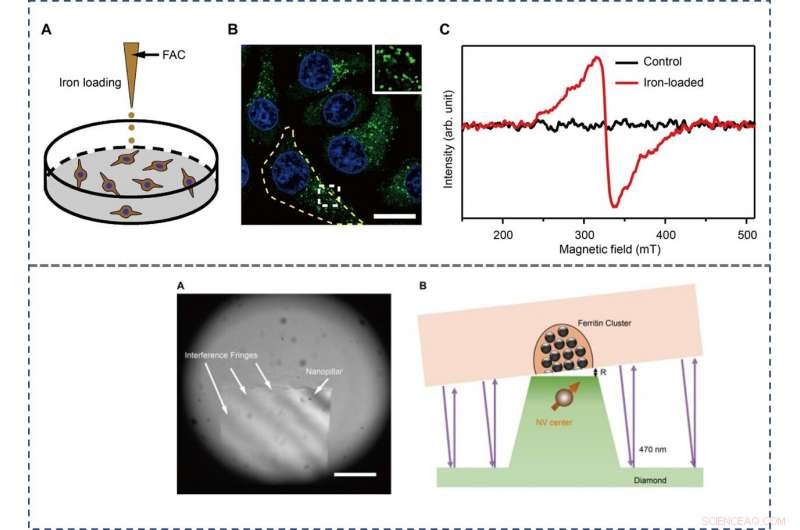
TOP - The preparation and characterization of ferritin-rich HepG2 cell samples. (A) Schematic view of the treatment to cultured cells. Following iron loading or no treatment, the HepG2 cells were examined for fluorescence images and EPR spectra, respectivement. For the MI and TEM imaging, cell samples were treated through high-pressure freezing, freeze substitution, and sectioning. (B) Representative confocal microscopy (CFM) image of ferritin structures (green) in iron-loaded HepG2 cells. The ferritin proteins were immunostained by anti-ferritin light chain antibody. The nuclei are indicated by 4′, 6-diamidino-2-phenylindole (DAPI) in the blue channel. Inset displays magnified ferritin structures. The yellow dashed line outlines the contour of a cell. Barre d'échelle, 20 μm. (C) EPR spectra of control and iron-loaded HepG2 cells at T =300 K. BOTTOM - Adjusting the distance between the NV center and the cell section. (A) Interference fringes between the cell cube and the diamond surface. Barre d'échelle, 20 μm. (B) The geometric relation and the gap R between cell samples and diamond-pillars for MI. The top surface diameter of the nanopillar is 400 nm. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
Wang et al. then used ultrafast, high-pressure freezing to immobilize all intracellular components of the Fe-loaded cells. The process stabilized the intracellular structures and molecules by minimizing Brownian motion in cells, which typically contributes to random motion of proteins up to 100 nm in vivo. To image the samples, they embedded and polymerized the frozen cells in LR White medium, followed by gluing the embedded cell sample to the AFM tuning fork with a few cells at the tip. Using a diamond knife, the scientists then sectioned the tip surface to nanometer flatness to examine the cuboid cell section under AFM. They acquired MI images of ferritins by scanning the cell cube along the diamond nanopillars and simultaneously measured NV spin repolarization rate using the "leapfrog" scanning mode of the microscope as detailed previously.
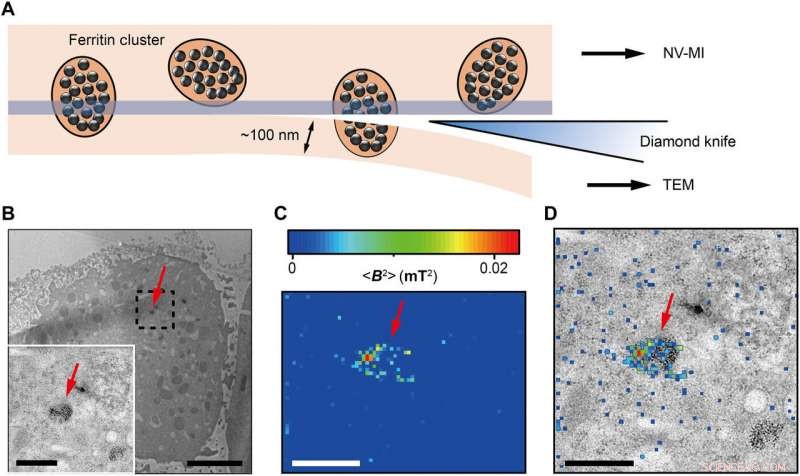
Correlative MI and TEM images. (A) Schematic view of sectioning for correlative MI and TEM imaging. The last section and the remaining cube were transferred for TEM imaging and MI scanning, respectivement. The sectioning resulted in some split ferritin clusters that could be imaged under both microscopes. A transparent blue strip of ~10 nm indicates the imaging depth of the MI, while in the TEM, the imaging depth is ~100 nm. (B) Distribution of ferritins from the last ultrathin section under TEM. Inset:Magnified figure of the part in black dashed box. (C) MI result of the remaining cell cube. The pixel size is 43 nm. (D) The merged MI and TEM micrograph shows ferritins in a membrane-bound organelle. The red arrows in (B) to (D) indicate the same ferritin cluster. Scale bars, 5 μm (B) and 1 μm [B (inset), C, and D]. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
The scientists measured fluorescence decay at a fixed free evolution time of 50 microseconds (τ =50 μs) to reveal the degree of NV sensor spin polarization, which correlated with the amount of ferritin in the sensing volume. They observed the appearance of some clusters via both TEM and MI images, although some details were not observed in MI, the results confirmed that spin noise from intracellular ferritin contributed to depolarize the NV center. In order to obtain details of the ferritin clusters at higher resolution, the scientists minimized the pixel size to 8.3 nm and acquired MI of high resolution of the proteins as expected.
De cette façon, Wang et al. explored the sensitivity of NV centers as an appropriate sensor for biological imaging applications at the level of the single molecule. They used the technique as a sensor in the experimental setup to obtain the first MI of a protein at a resolution of 10 nm in situ. The scientists aim to improve the stability and sensitivity of the technique to speed up the scanning process and image a larger area of interest in the cell and locate ferritin beyond the nucleus in association with additional organelles.
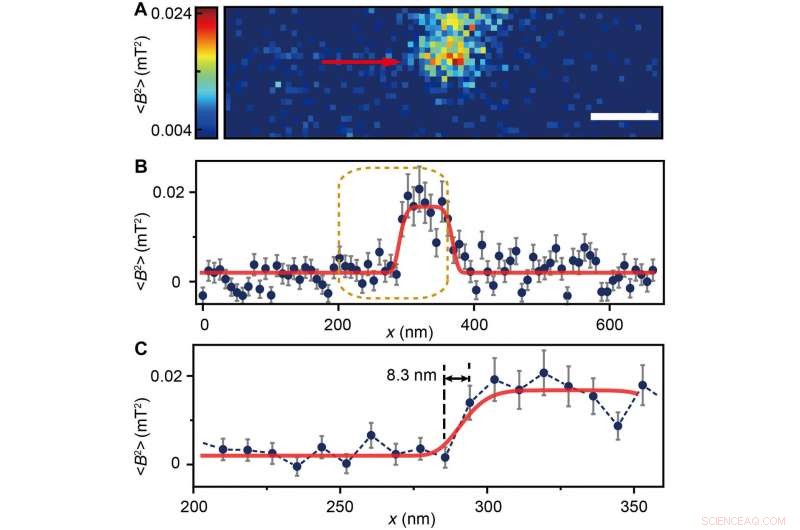
(A) Ferritin cluster imaged by the NV sensor with 80 × 24 pixels and a pixel size of 8.3 nm. Barre d'échelle, 100 nm. (B) Trace data of the scanning line in (A) directed by the red arrow. The platform indicates the ferritin cluster. The red curve fitted by a plateau function serves as a guide to the eye. (C) Magnified figure of the gold dashed box in (B). The sharp transition indicated by the red arrow around x =283 nm shows the scanning from the blank area to the area with ferritins. Credit:Science Advances, doi:10.1126/sciadv.aau8038.
The work will contribute to clinical diagnostics to determine biomarker-based iron storage and release in cells. This will include studies on the regulatory mechanisms of iron metabolism during the progression of hemochromatosis, anemia, liver cirrhosis and Alzheimer's disease. Wang et al. propose to extend the approach in situ to other cellular components with paramagnetic signals, including magnetic molecules, metalloproteins and special spin-labelled proteins. The scientists envision that further studies will explore additional targets suitable for high-resolution MI and correlated TEM imaging techniques, with optical microscopy detection incorporated to the experimental setup to extend the work and determine protein nuclear spin MRI as well as perform three-dimensional cell tomography.
© 2019 Réseau Science X