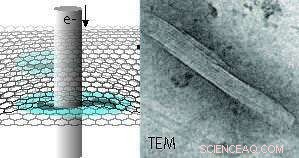
Représentation schématique de protéines de microtubules hydratées encapsulées entre deux couches de graphène imagées par microscopie électronique à transmission (MET). Un exemple d'image MET d'un microtubule est montré à droite. Le revêtement intérieur reflète la structure du protofilament du microtubule polymère. Gratuit dans ce communiqué de presse. Crédit :INM, Niels de Jonge
La microscopie électronique est l'une des principales méthodes utilisées pour examiner la structure des protéines. L'étude de ces structures est d'une importance capitale pour élucider leur fonction alimentant des informations fondamentales dans un certain nombre de domaines tels que la biologie structurale, biologie cellulaire, recherche contre le cancer, et d'autres domaines biomédicaux. Il améliore également la compréhension de la biominéralisation.
Une nouvelle option pour l'imagerie des protéines est la microscopie électronique en phase liquide (LPEM), qui est capable d'imager la structure protéique native (non colorée) et d'autres échantillons tels que des nanomatériaux ou des cellules dans un liquide. Cette technologie a été développée au cours des quinze dernières années. Jusque récemment, il a débattu pour savoir si la tolérance aux radiations des échantillons liquides serait meilleure ou pire par rapport à la glace amorphe. Dans leur récente publication, Sercan Keskin et Niels de Jonge de l'Institut INM-Leibniz pour les nouveaux matériaux démontrent maintenant, que la tolérance au rayonnement est augmentée d'un ordre de grandeur par rapport à un échantillon dans la glace. Ce résultat a été obtenu en préparant un échantillon de microtubules dans une cellule liquide au graphène. L'essentiel était d'utiliser une vitesse aussi faible que possible à laquelle l'irradiation par faisceau d'électrons était appliquée.
Traditionnellement, les échantillons ont été corrigés, teinté d'un métal pour accentuer leur contraste, ensuite séché, noyé dans du plastique, coupé en tranches fines, puis imagée dans l'environnement sous vide requis pour la microscopie électronique. La cryomicroscopie électronique surmonte les inconvénients associés à cette préparation d'échantillon et fournit les moyens d'étudier les protéines dans un état hydraté proche de l'état natif en les préparant dans de la glace amorphe. Cependant, une clé à imiter est la haute sensibilité des échantillons à l'irradiation par faisceau d'électrons, de sorte que le bruit statistique dans l'image empêche une résolution élevée et plusieurs dizaines de milliers d'images bruyantes de structures identiques doivent être imagées afin de résoudre la structure.