Crédit :Wiley
Des traces de biomolécules telles que l'ADN peuvent être détectées grâce à une nouvelle technique "dynamique" basée sur l'observation d'événements d'association et de dissociation de nanoparticules d'or. Si la séquence d'ADN souhaitée est présente, il peut lier de manière réversible deux nanoparticules ensemble. Cela peut être détecté en temps réel grâce à un changement de diffusion de la lumière. Comme indiqué dans le journal Angewandte Chemie , cette méthode différencie les vrais signaux du bruit et peut détecter les écarts de bases individuelles.
La détection et la quantification de biomolécules à des concentrations extrêmement faibles sont de plus en plus importantes pour des applications telles que le diagnostic précoce et précis, suivi des traitements anticancéreux, enquêtes médico-légales, et des tests hautement sensibles pour les armes biologiques. La méthode de choix actuelle est la réaction en chaîne par polymérase (PCR), qui est basé sur la réplication enzymatique de l'ADN. L'inconvénient de cette méthode réside dans les faux positifs qui peuvent résulter des plus petites quantités d'impuretés.
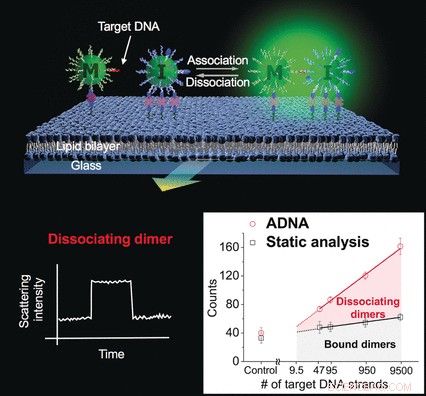
Des scientifiques travaillant avec Jwa-Min Nam à l'Université nationale de Séoul (Corée du Sud) ont maintenant développé une nouvelle méthode pour détecter des quantités extrêmement petites d'ADN - sans réplication, amplification du signal, ou des résultats faussement positifs. Leur méthode est basée sur la détection d'événements de liaison individuels. Parce que les partenaires de liaison se séparent continuellement puis se lient à nouveau, le nombre de résultats détectables est multiplié et les signaux non spécifiques sont minimisés. Cette analyse de nanodimères d'association et de dissociation (ADNA) est basée sur la mesure de la diffusion de la lumière par des nanoparticules d'or en utilisant la microscopie à fond noir.
L'échantillon et deux types de nanoparticules d'or sont placés sur une lame de verre recouverte d'une double couche lipidique. Un type de nanoparticule a des sites de liaison sur la surface qui s'ancrent à la couche lipidique. L'autre type se lie de manière réversible à la couche lipidique, restant mobile. Les deux nanoparticules ont de courts segments d'ADN simple brin qui sont complémentaires de deux séquences différentes dans l'ADN cible afin qu'elles puissent le lier. Lorsqu'une nanoparticule mobile s'approche de très près d'une nanoparticule immobilisée, l'ADN cible peut les lier en un dimère.
Lorsque deux nanoparticules sont liées, leurs vibrations (plasmons) sont couplées. Cela modifie l'intensité et la couleur de la lumière diffusée, qui peut être détecté en temps réel. L'analyse dynamique des dimères qui se sont dissociés lors de l'observation est la clé de la différenciation claire entre la présence et l'absence de l'ADN cible. La cinétique de la dissociation est significativement différente pour l'ADN qui correspond parfaitement et l'ADN avec une seule base altérée.
Même en présence d'un autre ADN, comme dans un échantillon de sérum sanguin humain, il a été possible de détecter sélectivement et de quantifier de manière fiable des concentrations ultra-faibles de l'ADN cible. Dans les conditions d'essai utilisées, la limite de détection était d'environ 46 copies d'ADN.