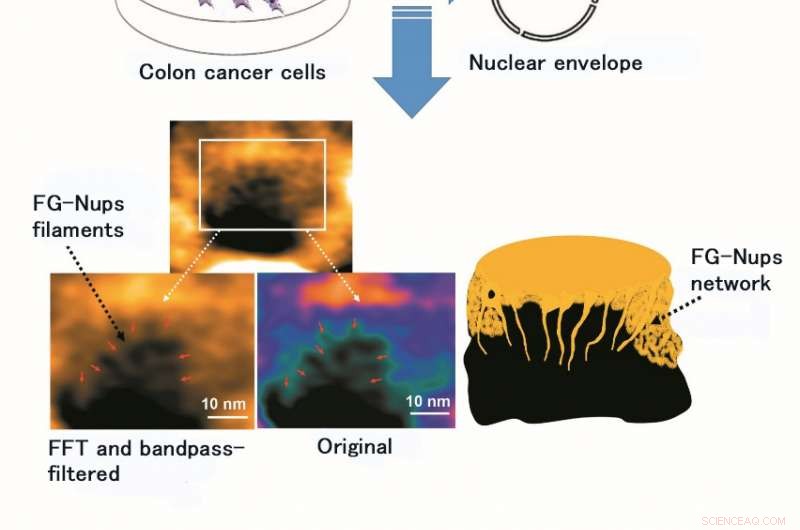
L'utilisation du HS-AFM a permis l'observation et l'imagerie vidéo de la structure et de la dynamique du filament FG-Nups, un complexe protéique de doublure douce et flexible. La figure montre l'image originale du filament FG-Nups et celle après traitement par transformation de Fourier rapide (FFT) et un filtre passe-bande (un filtre passe-bande permet la perméation de la lumière de certaines longueurs d'onde uniquement). Crédit :Université de Kanazawa
L'une des principales raisons de la mortalité par cancer est le comportement hautement invasif des cellules cancéreuses, qui est souvent due à des métastases agressives. La métastase est facilitée par divers facteurs de croissance et cytokines sécrétées par les cellules du système immunitaire, qui fonctionnent à travers diverses voies de signalisation. Remarquablement, ces voies de signalisation pénètrent dans le noyau à travers le complexe des pores nucléaires (NPC), qui est censé agir comme un portier vers le noyau. Le PNJ est, En réalité, une nanomachine constituée de multiples copies d'une trentaine de protéines différentes, collectivement appelée nucléoporine.
Bien que les petites molécules puissent traverser les pores nucléaires assez librement, les molécules de plus de 40 kDa ne pourraient le faire efficacement qu'en se liant à des protéines de transport spécifiques qui interagissent avec les FG-Nups (les nucléoporines ont des unités répétitives de deux acides aminés phénylalanine (F) et glycine (G), qui sont les protéines tentaculaires ayant des rôles spécifiques et sélectifs dans le transport des pores. Bien que différents modèles soient proposés, comment FG-Nups participe au transport noyau-cytoplasme reste largement inconnu. Néanmoins, l'évaluation concomitante des structures et dynamiques nanoscopiques a été techniquement irréalisable, une situation qui prévaut tout au long de la recherche en biologie cellulaire. La visualisation directe de la dynamique des PNJ à une résolution nanométrique était considérée comme impossible.
L'équipe de recherche de l'Université de Kanazawa a étudié cette question importante et a obtenu des résultats révolutionnaires en combinant l'imagerie cellulaire vivante à haute résolution, microscopie électronique, et l'AFM à grande vitesse (HS-AFM) qui est développé par eux-mêmes pour étudier la dynamique spatiale et temporelle nanoscopique native dans les structures NPC dans les cellules cancéreuses du côlon.
D'abord, ils ont généré des lignées cellulaires stables NPC exprimant la GFP (protéine fluorescente verte) et confirmées par microscopie à fluorescence. Prochain, ils ont isolé l'enveloppe nucléaire hautement purifiée, ce qui a été confirmé par l'utilisation de la microscopie électronique à coloration négative et de la microscopie confocale. Puis, ils ont commencé l'observation des changements spatio-temporels à l'échelle de la milliseconde et du nanomètre de la structure NPC à l'état natif dans les cellules cancéreuses du côlon en combinant l'imagerie de cellules vivantes à haute résolution et la microscopie électronique. Notamment, ils ont effectué l'observation de l'enveloppe nucléaire vivante et des pores nucléaires en utilisant HS-AFM.
L'équipe de recherche de l'Université de Kanazawa était, En effet, réussi à imager la dynamique des protéines NPC dans les cellules cancéreuses, qui sont les éléments constitutifs du pore nucléaire (Figure 1). MLN8237/alisertib, un inducteur apoptotique et autophagique, fait actuellement l'objet de plusieurs essais cliniques sur le cancer. Il a été rapporté que ce médicament inhibe l'expression et les activités de la nucléoporine. Les chercheurs ont visualisé des FG-Nups natifs et traités par HS-AFM. En particulier, les FG-Nups étendus et rétractés ayant l'apparence d'une toile d'araignée ont été perdus dans les échantillons traités par le médicament (Figure 2). L'équipe de recherche a conclu que via HS-AFM, ils ont visualisé la déformation et la perte de la barrière des pores nucléaires FG-Nups, qui pourrait être le premier code nano mourant découvert dans le monde.
La présente étude menée par l'équipe de recherche de l'Université de Kanazawa a permis de visualiser la structure et la dynamique du pore de la membrane nucléaire à l'échelle nanométrique, et il est démontré que la déformation et la perte de la barrière des pores de la membrane nucléaire seraient l'un des codes de la mort des cellules cancéreuses. Ces résultats représentent un nouveau paradigme dans notre compréhension du transport nucléaire, qui a, jusqu'à ce point, est resté un problème énigmatique dans tout le domaine de la nano-médecine et de la biologie cellulaire. Les découvertes actuelles sont basées sur la technologie de bio-imagerie de couronnement développée à l'Université de Kanazawa. Cette étude a des applications médicales, notamment en agissant comme une nouvelle « nano-endoscopie » pour visualiser les organites intracellulaires tels que le noyau et les pores nucléaires, et la dynamique moléculaire dans les cellules cancéreuses et d'autres maladies.
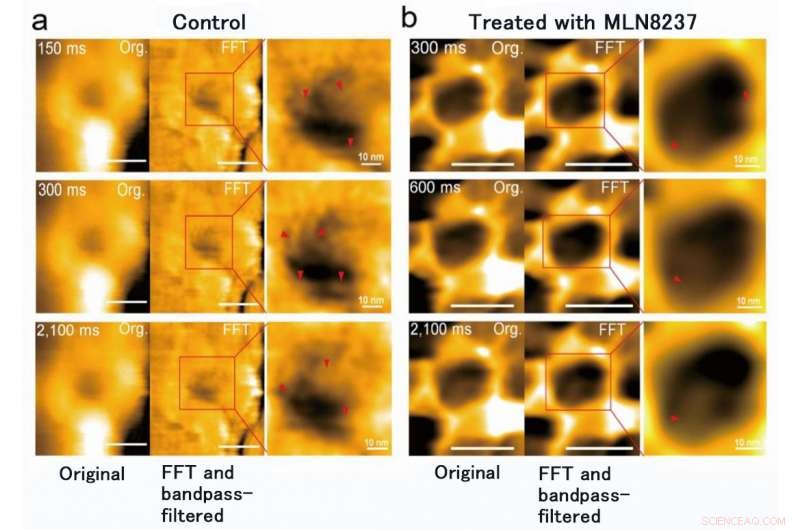
Le traitement MLN8237 des cellules cancéreuses a provoqué une déformation et une perte de la barrière FG-Nups. Il a également été constaté que le diamètre interne du pore nucléaire est passé de 86 ± 13 nm à 53 ± 9 nm et la profondeur, de 4 ± 2 nm à 7 ± 1 nm. Crédit :Université de Kanazawa