Une étude sur le cancer de l'Université du Colorado montre comment les nanoparticules activent le système du complément, ouvrant potentiellement la voie à une utilisation accrue de ces technologies. Crédit :Centre de cancérologie de l'Université du Colorado
Dans le laboratoire, les médecins peuvent attacher la chimiothérapie aux nanoparticules qui ciblent les tumeurs, et peut utiliser des nanoparticules pour améliorer l'imagerie par IRM, TEP et tomodensitométrie. Malheureusement, les nanoparticules ressemblent beaucoup à des agents pathogènes - l'introduction de nanoparticules dans le corps humain peut entraîner une activation du système immunitaire dans laquelle, au mieux, les nanoparticules sont nettoyées avant d'atteindre leur objectif, et au pire, l'apparition d'une réaction allergique dangereuse. Un article du University of Colorado Cancer Center publié aujourd'hui dans la revue Nature Nanotechnologie détaille comment le système immunitaire reconnaît les nanoparticules, ouvrant potentiellement la voie pour contrer ou éviter cette détection.
Spécifiquement, l'étude a travaillé avec des nanoparticules d'oxyde de fer recouvertes de dextrane, une classe prometteuse et polyvalente de particules utilisées comme véhicules d'administration de médicaments et activateurs de contraste IRM dans de nombreuses études. Comme leur nom l'indique, les particules sont de minuscules taches d'oxyde de fer incrustées de chaînes de sucre.
"Nous avons utilisé plusieurs approches de microscopie sophistiquées pour comprendre que les particules ressemblent essentiellement à des chenilles, " dit Dmitri Simberg, Doctorat, chercheur au CU Cancer Center et professeur adjoint à la Skaggs School of Pharmacy and Pharmaceutical Sciences, l'auteur principal de l'article.
La comparaison est frappante :la particule d'oxyde de fer est le corps de la chenille, qui est entouré de fins poils de dextrane.
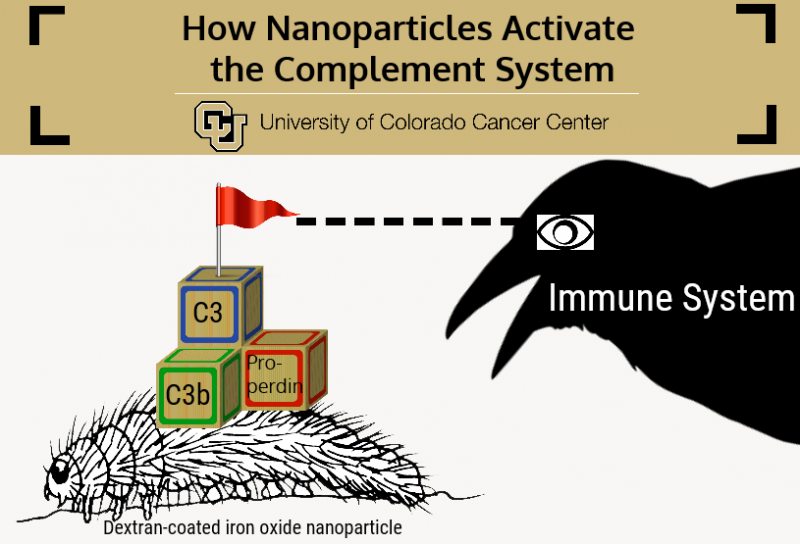
Si les nanoparticules d'oxyde de fer recouvertes de dextrane de Simberg sont des chenilles, alors le système immunitaire est un gros corbeau qui les mangerait - c'est-à-dire, s'il peut les trouver. En réalité, le système immunitaire a évolué exactement dans ce but - pour trouver et "manger" des particules étrangères - et plutôt qu'une entité homogène est en fait composée d'une poignée de systèmes interdépendants, chacun spécialisé pour contrer une forme spécifique de particule envahissante.
Les travaux antérieurs de Simberg montrent que c'est le sous-composant immunitaire appelé système du complément qui défie le plus les nanoparticules. Essentiellement, le système du complément est un groupe d'un peu plus de 30 protéines qui circulent dans le sang et se fixent aux particules envahissantes et aux agents pathogènes. Chez l'homme, l'activation du système du complément nécessite que trois protéines se réunissent sur une particule -C3b, Bb et properdine - qui forment un complexe stable appelé C3-convertase.
"L'ensemble de l'activation du système du complément commence par l'assemblage de la C3-convertase, " dit Simberg. " Dans cet article, nous posons la question de savoir comment les protéines du complément reconnaissent réellement la surface des nanoparticules. Comment toute cette réaction est-elle déclenchée ? »
D'abord, il était clair que le revêtement de dextrane qui était censé protéger les nanoparticules des attaques du complément humain ne faisait pas son travail. Simberg et ses collègues ont pu voir des protéines du complément envahir littéralement la barrière des poils de dextrane.
"Les images de microscopie électronique montrent que la protéine pénètre à l'intérieur de la particule pour toucher le noyau d'oxyde de fer, " dit Simberg.
En réalité, tant que le revêtement de nanoparticules a permis à la nanoparticule d'absorber les protéines du sang, la convertase C3 a été assemblée et activée sur ces protéines. La composition du revêtement n'avait aucune importance - si une protéine sanguine était capable de se lier aux nanoparticules, elle conduit toujours à l'activation complémentaire. De plus, Simberg et ses collègues ont également montré que l'activation du système du complément est un processus dynamique et continu - les protéines sanguines et la convertase C3 se dissocient constamment des nanoparticules, et de nouvelles protéines et convertases C3 se lient aux particules, poursuivre la cascade d'activation du système immunitaire. Le groupe a également démontré que cet assemblage dynamique de protéines du complément se produit non seulement dans les tubes à essai mais aussi dans les organismes vivants lorsque les particules circulent dans le sang.
Simberg suggère que le travail pointe vers des défis et trois stratégies possibles pour éviter l'activation du système complémentaire par les nanoparticules :« Premièrement, nous pourrions essayer de changer le revêtement des nanoparticules afin qu'il ne puisse pas absorber les protéines, ce qui est une tâche difficile; seconde, nous pourrions mieux comprendre la composition des protéines absorbées du sang à la surface des particules qui lui permettent de se lier aux protéines du complément; et troisième, il existe des inhibiteurs naturels de l'activation du complément - par exemple le facteur H sanguin - mais dans le cadre des nanoparticules, ce n'est pas assez fort pour arrêter l'activation du complément. Peut-être pourrions-nous obtenir des nanoparticules pour attirer plus de facteur H afin de diminuer cette activation. »
À un moment donné, le concept de nanomédecine semblait simple :les ingénieurs et les chimistes fabriqueraient une nanoparticule ayant une affinité pour le tissu tumoral, puis y attacheraient une molécule de médicament. Ou ils injecteraient des nanoparticules aux patients qui amélioreraient la résolution de l'imagerie diagnostique. Lorsque les réalités associées à l'utilisation des nanoparticules dans le paysage du système immunitaire humain se sont avérées plus difficiles, de nombreux chercheurs ont réalisé la nécessité de prendre du recul par rapport à une éventuelle utilisation clinique pour mieux comprendre les mécanismes qui remettent en cause l'utilisation des nanoparticules.
« Ce travail de base est absolument nécessaire, " dit Seyed Moein Moghimi, Doctorat, nanotechnologue à l'Université de Durham, ROYAUME-UNI, et le coauteur de l'article de Simberg. "Il est essentiel que nous apprenions à contrôler le processus de reconnaissance immunitaire afin de pouvoir faire le pont entre la promesse que les nanoparticules démontrent en laboratoire et leur utilisation avec de vrais patients dans le monde réel."