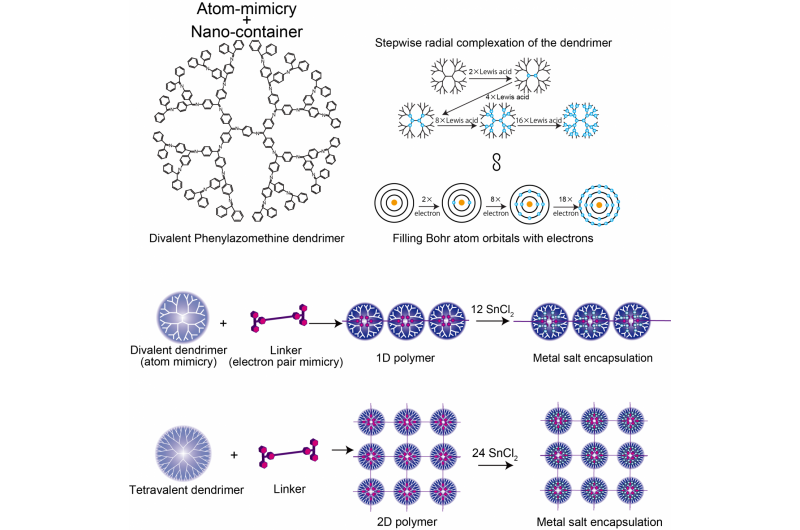
La structure du dendrimère de la phénylazomenthine divalente, Comparaison du modèle d'atome DPA et Bohr, et polymère supramoléculaire 1D/2D. Crédit : Institut de technologie de Tokyo
En nanotechnologie, le contrôle est essentiel. Le contrôle des dispositions et des distances entre les nanoparticules peut permettre des forces d'interaction adaptées afin que les propriétés puissent être exploitées dans des dispositifs tels que les capteurs plasmoniques. Désormais, les chercheurs de l'Institut de technologie de Tokyo utilisent des dendrimères qui imitent la valence électronique des atomes et les relient en réseaux à l'aide de molécules qui se coordonnent avec le dendrimère car ils formeraient une paire d'électrons covalente dans leur couche de valence - "mimétisme de paires d'électrons".
Kimihisa Yamamoto, Ken Albrecht, et ses collègues de Tokyo Tech ont considéré la polyphénylazométhine dendritique (DPA), qui a une structure qui se ramifie à partir d'un noyau central. Les molécules "d'acide de Lewis" se coordonnent aux sites de "base de Lewis" de DPA. L'analyse du rapport des molécules d'acide de Lewis SnCl2 se coordonnant avec chaque dendrimère a révélé des augmentations de pas de 2 à 4 à 8 à 16, qui imite la valence de l'atome de Bohr qui a 2, 8, 18, et 32 électrons dans le 1er, 2e, 3e, et 4e orbitales. Cela reflète l'augmentation du nombre de molécules qui peuvent se coordonner avec le dendrimère avec l'augmentation de la distance du noyau, à mesure que le nombre de branches de dendrimère et la densité électronique augmentent.
L'équipe de Yamamoto a analysé la coordination du DPA avec un acide de Lewis à liaison plus forte - le triphénylméthylium (TPM) - lié à la molécule en forme de tige phénylène éthynylène. Le squelette phylène éthylène est suffisamment rigide pour que les cations acides à chaque extrémité ne puissent pas alors se lier au même dendrimère. Au lieu de cela, une chaîne polymère de dendrimères se forme. L'utilisation d'un dendrimère de départ différent (ZnPG4 au lieu de DPAG4) - qui a une valence centrale de quatre au lieu de deux - a conduit à la formation d'une polymérisation bidimensionnelle des dendrimères, produire un réseau 2D de nanoconteneurs pouvant accumuler d'autres acides de Lewis dans les orbitales externes.
L'ouvrage décrit "un nouvel aspect du mimétisme atomique", concluent les chercheurs. "La géométrie et le pas peuvent être contrôlés par la conception du dendrimère et du lieur et sont potentiellement applicables à la plasmonique (après croissance induite par les semences) et aux grilles de nanoélectrodes (qui sont également utiles comme électrocatalyseurs)."
L'étude est publiée dans Avancées scientifiques .
atome de Bohr
Le modèle de Bohr de l'atome présenté par Niels Bohr et Ernest Rutherford en 1913 décrit l'atome comme un noyau positif entouré d'électrons dans différentes couches ou niveaux d'énergie. Chaque couche a un nombre prescrit d'électrons qui peuvent l'occuper - c'est-à-dire, deux électrons peuvent occuper la première couche, huit le suivant, et dix-huit le suivant, etc.
Bien qu'il y ait des aspects du comportement de l'atome que le modèle ne couvre pas, il est particulièrement efficace pour expliquer les raies spectrales d'émission. Lorsqu'il est excité, un électron peut sauter au niveau d'énergie suivant. Lorsqu'il revient au niveau d'énergie initial, la différence des énergies est émise sous forme de lumière à la longueur d'onde spécifique équivalente à la différence d'énergie.
Lorsqu'une coquille n'est pas pleine, l'atome peut se lier à une autre espèce chimique. De cette façon, la valence d'un atome décrit le degré de remplissage de la couche électronique et la facilité avec laquelle des liaisons peuvent se former. Le gradient de densité électronique des dendrimères se déplaçant radialement du noyau vers les régions externes plus ramifiées dicte le nombre de molécules de coordination d'acide de Lewis qu'il peut accueillir et, de cette manière, il imite les niveaux d'énergie de l'atome de Bohr.
Qu'est-ce qu'un acide de Lewis
Un acide de Lewis est une espèce chimique qui peut accepter une seule paire d'électrons d'un produit chimique qui peut donner une seule paire, C'est, d'une base de Lewis. Ce comportement est défini par la structure électronique du produit chimique. Les acides de Lewis comprennent des composés acides mais aussi des cations métalliques.
Lorsque le dendrimère se coordonne avec les acides de Lewis, il prend la place de la base de Lewis qui donnerait une paire d'électrons. Les chercheurs décrivent le composé acide di-Lewis (molécule de liaison) comme un mimétisme de paires d'électrons.
Points isobestiques
Lorsque deux produits chimiques réagissent, la quantité de lumière absorbée peut changer en fonction de la quantité de lumière absorbée par les produits par rapport aux réactifs. Si les produits et les réactifs absorbent la même quantité de lumière à une longueur d'onde particulière, il est décrit comme le point isobestique.
Les chercheurs ont utilisé des points isobestiques pour identifier les augmentations progressives de la réaction de l'acide de Lewis avec les dendrimères. Un décalage de longueur d'onde dans le point isobestique indique une coordination de l'acide de Lewis à la couche suivante du dendrimère.