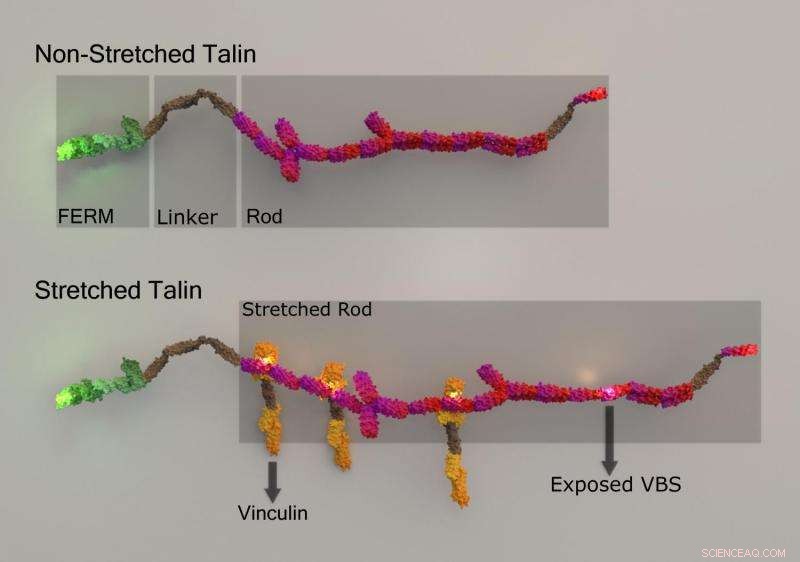
Étirement de Talin et liaison à la vinculine induite par l'étirement. Crédit :Université nationale de Singapour
Des chercheurs du Mechanobiology Institute (MBI) de l'Université nationale de Singapour ont mis au point une nouvelle méthode, en microscopie super-résolution, déterminer la longueur des protéines étirées dans les cellules vivantes, et surveiller la liaison dynamique des protéines, à des échelles de temps inférieures à la seconde. Cette étude a été publiée dans Lettres nano en mai 2016.
Les cellules sont constamment exposées à des forces mécaniques. Ces signaux influencent la prise de décision cellulaire en fournissant des informations dont les cellules ont besoin pour déterminer la quantité d'une protéine particulière à produire, quand un gène spécifique doit être exprimé, ou même si une cellule doit bouger ou rester où elle est. Ces informations sont cruciales, par exemple, dans le maintien de la santé, l'intégrité et la réparation des tissus à mesure que nous vieillissons. Un exemple clair de quand les cellules sont exposées à des forces est quand nous marchons. Des forces d'étirement ou de traction sont générées dans nos muscles, et ceux-ci sont passés par le muscle au tissu conjonctif et à l'os. Bien que ces informations soient générées au niveau des tissus, il converge sur des cellules individuelles au sein de ces tissus, et est détecté et mesuré par subcellulaire, à base de protéines, Machines.
Pour mesurer les forces appliquées à une cellule, des protéines spécialisées peuvent être déformées. Cela se produit souvent lorsqu'une protéine est étirée, tout comme la façon dont une bande élastique s'étire lorsqu'elle est soumise à des forces de traction. L'étirement des protéines peut exposer des régions à l'intérieur de celles-ci qui seraient autrement cachées. Ces régions peuvent servir de sites d'amarrage pour la fixation d'autres protéines. Cela provoque un effet boule de neige, où de plus en plus de protéines sont capables de se lier, et des complexes moléculaires plus grands ou des machines se forment pour médier une fonction cellulaire spécifique. Ce phénomène a été récemment exploré par le directeur du MBI, Professeur Michael Sheetz, Chercheur principal Dr Felix Margadant et doctorante Mme Xian Hu (Edna), dans des travaux axés sur la caractérisation de l'étirement d'une protéine à détection de force appelée taline, et établir l'effet qu'il a sur la liaison d'une autre protéine appelée vinculine.
Bien que plusieurs études aient montré l'étirement induit par la force de la liaison taline et taline-vinculine in vitro, la visualisation simultanée de ces deux événements et de leur corrélation avec des fonctions cellulaires spécifiques n'était pas possible auparavant dans les cellules vivantes en raison des échelles de temps rapides auxquelles ils se produisent. Aussi, la réalisation d'une imagerie multicolore à super résolution dans des cellules vivantes est encore très difficile. Pour surmonter ces défis, Le professeur Sheetz et Mme Hu ont développé un roman, et une méthode d'imagerie à super-résolution très avancée, qui leur a permis de surveiller simultanément la longueur de taline dans les cellules vivantes, ainsi que la dynamique de liaison de la vinculine, au niveau d'une seule molécule et à l'échelle de la milliseconde.
En attachant différentes molécules fluorescentes (GFP et mCherry), à chaque extrémité de la taline et un troisième fluorophore (Atto655) à la vinculine, les chercheurs ont pu surveiller l'emplacement subcellulaire précis de chaque protéine, et confirmez que lorsque Talin était étiré, vinculine liée aux sites nouvellement exposés. De façon intéressante, leurs découvertes ont souvent révélé une liaison groupée, avec cinq molécules de vinculine ou plus se liant à la taline en une seconde. De plus, la liaison des premières vinculines semble favoriser énergétiquement la liaison successive d'autres molécules de vinculine. Corréler la dynamique de liaison de la vinculine avec la quantité d'étirement de la taline, les chercheurs ont noté que la liaison maximale à la vinculine se produisait à une extrémité spécifique de la taline (la région N-terminale), lorsque la taline a été étirée à environ 180 nm.
Comprendre comment la taline et la vinculine réagissent aux forces d'étirement est crucial pour comprendre comment les cellules réagissent aux forces de notre corps. Dans ce cas, les deux protéines se trouvent dans des machines moléculaires plus grandes appelées adhérences focales, qui relient physiquement l'intérieur d'une cellule avec le matériau qui l'entoure, la matrice extracellulaire. Les adhérences focales fonctionnent principalement comme des centres de relais de signaux, et les informations qu'ils transfèrent peuvent induire la croissance et le mouvement cellulaires. Lorsque ce traitement du signal est perturbé, ou n'est pas réglementé, des états pathologiques surviennent et la capacité du corps à guérir les blessures, ou maintenir l'intégrité des tissus à mesure que nous vieillissons s'altère.
Bien qu'important pour faciliter ces processus cellulaires et tissulaires plus larges, l'interaction taline-vinculine n'est qu'une des nombreuses interactions protéiques pour répondre à la force. On espère que cette méthode nouvellement décrite ouvrira la voie aux chercheurs pour disséquer d'autres interactions protéiques, à la fois dans les adhérences focales, et dans d'autres machines moléculaires, améliorer notre compréhension des nombreux processus cellulaires induits par la force qui surviennent au cours du développement et se poursuivent jusqu'au vieillissement.