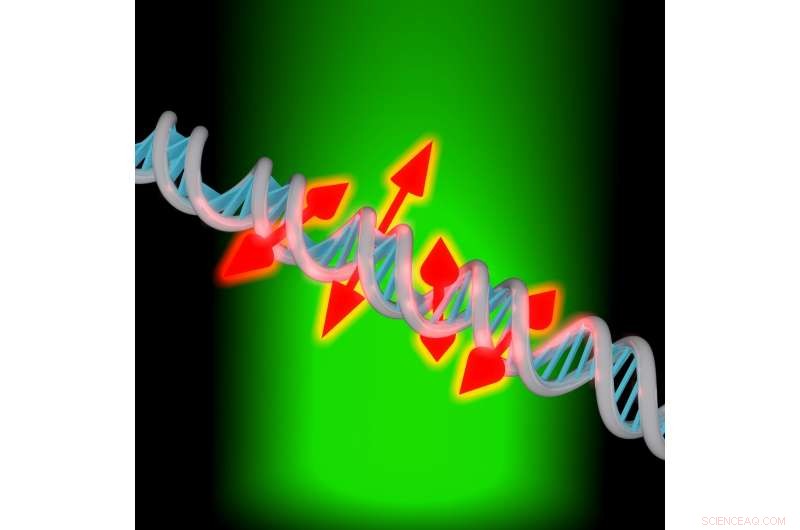
Une nouvelle technique d'imagerie permet aux chercheurs d'imager à la fois la position et l'orientation de molécules fluorescentes uniques attachées à l'ADN. Crédit :Maurice Y. Lee, Université de Stanford
Les chercheurs ont développé une nouvelle technique d'imagerie de l'ADN améliorée qui peut sonder la structure des brins d'ADN individuels à l'échelle nanométrique. Étant donné que l'ADN est à l'origine de nombreux processus pathologiques, la technique pourrait aider les scientifiques à obtenir des informations importantes sur ce qui ne va pas lorsque l'ADN est endommagé ou lorsque d'autres processus cellulaires affectent l'expression des gènes.
La nouvelle méthode d'imagerie s'appuie sur une technique appelée microscopie à molécule unique en ajoutant des informations sur l'orientation et le mouvement des colorants fluorescents attachés au brin d'ADN.
W.E. Moerner, Université de Stanford, ETATS-UNIS, est le fondateur de la spectroscopie monomoléculaire, une méthode révolutionnaire de 1989 qui a permis aux scientifiques de visualiser pour la première fois des molécules uniques par microscopie optique. Parmi les lauréats du prix Nobel 2014 pour la microscopie optique au-delà de la limite de diffraction (Moerner, Enfer &Betzig), Moerner et Betzig ont utilisé des molécules uniques pour imager un réseau dense de molécules à différents moments.
Dans le journal de la Optical Society pour la recherche à fort impact, Optique , l'équipe de recherche dirigée par Moerner décrit leur nouvelle technique et la démontre en obtenant des images de super-résolution et des mesures d'orientation pour des milliers de molécules de colorant fluorescent unique attachées à des brins d'ADN.
"Vous pouvez considérer ces nouvelles mesures comme fournissant de petites flèches à double tête qui montrent l'orientation des molécules attachées le long du brin d'ADN, " a déclaré Moerner. " Cette information d'orientation rend compte de la structure locale des bases d'ADN car elles contraignent la molécule. Si nous n'avions pas cette information d'orientation, l'image ne serait qu'un point."
Ajouter plus d'informations à l'échelle nanométrique
Un brin d'ADN est un très long, mais chaîne étroite, à peine quelques nanomètres de diamètre. Microscopie monomoléculaire, avec des colorants fluorescents qui se fixent à l'ADN, peut être utilisé pour mieux visualiser cette petite chaîne. Jusqu'à maintenant, il était difficile de comprendre comment ces colorants étaient orientés et impossible de savoir si le colorant fluorescent était attaché à l'ADN de manière rigide ou quelque peu lâche.
Adam S. Backer, premier auteur de l'article, développé un moyen assez simple d'obtenir l'orientation et la dynamique de rotation de milliers de molécules simples en parallèle. "Notre nouvelle technique d'imagerie examine comment chaque molécule de colorant individuelle marquant l'ADN est alignée par rapport à la structure beaucoup plus grande de l'ADN, " a déclaré Backer. " Nous mesurons également à quel point chacune de ces molécules est instable, qui peut nous dire si cette molécule est coincée dans un alignement particulier ou si elle bascule au cours de notre séquence de mesure. »
La nouvelle technique offre des informations plus détaillées que les méthodes d'aujourd'hui dites "d'ensemble", qui moyenne les orientations pour un groupe de molécules, et c'est beaucoup plus rapide que les techniques de microscopie confocale, qui analysent une molécule à la fois. La nouvelle méthode peut même être utilisée pour des molécules relativement faibles.
Parce que la technique fournit des informations à l'échelle nanométrique sur l'ADN lui-même, il pourrait être utile pour surveiller les changements de conformation de l'ADN ou les dommages causés à une région particulière de l'ADN, qui se manifesteraient par des changements dans l'orientation des molécules de colorant. Il pourrait également être utilisé pour surveiller les interactions entre l'ADN et les protéines, qui pilotent de nombreux processus cellulaires.
30, 000 orientations de molécule unique
Les chercheurs ont testé la technique d'imagerie ADN améliorée en l'utilisant pour analyser un colorant intercalant; un type de colorant fluorescent qui glisse dans les zones entre les bases d'ADN. Dans une expérience d'imagerie typique, ils acquièrent jusqu'à 300, 000 emplacements de molécules uniques et 30, 000 mesures d'orientation de molécules uniques en un peu plus de 13 minutes. L'analyse a montré que les molécules de colorant individuelles étaient orientées perpendiculairement à l'axe du brin d'ADN et que tandis que les molécules avaient tendance à s'orienter dans cette direction perpendiculaire, ils se déplaçaient également à l'intérieur d'un cône contraint.
Les enquêteurs ont ensuite effectué une analyse similaire en utilisant un type différent de colorant fluorescent qui se compose de deux parties :une partie qui se fixe sur le côté de l'ADN et une partie fluorescente qui est connectée via une attache souple. La technique d'imagerie ADN améliorée a détecté cette instabilité, montrant que la méthode pourrait être utile pour aider les scientifiques à comprendre, molécule par molécule, si différentes étiquettes s'attachent à l'ADN de manière mobile ou fixe.
Dans le journal, les chercheurs ont démontré une résolution spatiale d'environ 25 nanomètres et des mesures d'orientation de molécule unique avec une précision d'environ 5 degrés. Ils ont également mesuré la dynamique de rotation, ou mollesse, de molécules uniques avec une précision d'environ 20 degrés.
Comment ça fonctionne
Pour acquérir des informations d'orientation sur une molécule unique, les chercheurs ont utilisé une technique bien étudiée qui ajoute un élément optique appelé modulateur électro-optique au microscope à molécule unique. Pour chaque cadre de caméra, cet appareil modifiait la polarisation de la lumière laser utilisée pour éclairer tous les colorants fluorescents.
Étant donné que les molécules de colorant fluorescent avec les orientations les plus étroitement alignées avec la polarisation de la lumière laser apparaîtront les plus brillantes, measuring the brightness of each molecule in each camera frame allowed the researchers to quantify orientation and rotational dynamics on a molecule-by-molecule basis. Molecules that switched between bright and dark in sequential frames were rigidly constrained at a particular orientation while those that appeared bright for sequential frames were not rigidly holding their orientation.
"If someone has a single-molecule microscope, they can perform our technique pretty easily by adding the electro-optic modulator, " said Backer. "We've used fairly standard tools in a slightly different way and analyzed the data in a new way to gain additional biological and physical insight."