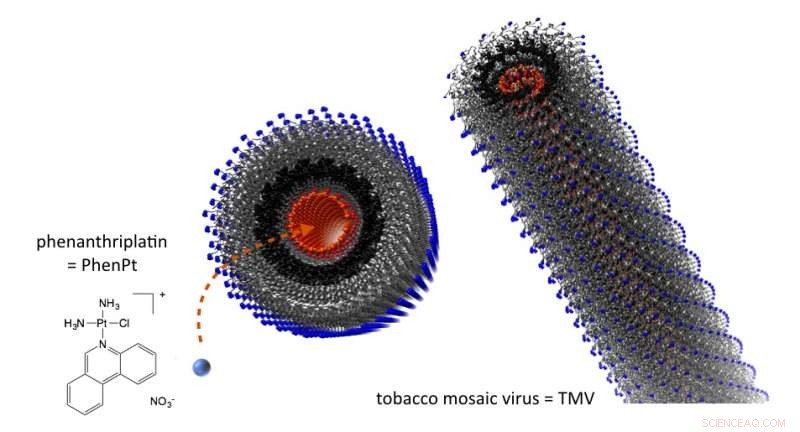
Lorsqu'il est emballé dans des nanoparticules du virus de la mosaïque du tabac, le phénanthriplatine est délivré aux tumeurs, où il s'est avéré plus efficace in vivo qu'un platine approuvé. Crédit:Case Western Reserve University
Dans une paire de premières, des chercheurs de la Case Western Reserve University et du Massachusetts Institute of Technology ont montré que le candidat-médicament phénanthriplatine peut être plus efficace qu'un médicament approuvé in vivo, et qu'un vecteur à base de virus végétal délivre avec succès un médicament in vivo.
Les tumeurs du cancer du sein triple-négatives des souris traitées avec des nanoparticules porteuses de phénanthriplatine étaient quatre fois plus petites que celles traitées avec du cisplatine, un médicament de chimiothérapie commun et apparenté, ou phénanthriplatine libre injecté par voie intraveineuse dans la circulation.
Les scientifiques croient au travail, rapporté dans le journal ACS Nano , est une étape prometteuse vers les essais cliniques.
« Nous avons peut-être trouvé le support parfait pour ce candidat-médicament particulier, " a déclaré Nicole Steinmetz, professeur adjoint de génie biomédical à Case Western Reserve, qui a passé 10 ans à étudier l'utilisation des virus végétaux à des fins médicales.
Elle a fait équipe avec Stephen J. Lippard, Arthur Amos Noyes Professeur de chimie au MIT, et un expert en interactions biologiques impliquant des chimiothérapies à base de platine.
Les médicaments à base de platine sont utilisés pour traiter plus de la moitié des patients cancéreux recevant une chimiothérapie. Deux des médicaments les plus couramment utilisés sont le cisplatine et le carboplatine. Ils forment des liaisons croisées bifonctionnelles avec l'ADN dans les cellules cancéreuses, qui empêchent l'ADN de transcrire les gènes et entraînent la mort cellulaire, Lippard a expliqué.
Malgré une utilisation généralisée, il a été démontré que le cisplatine ne guérit que le cancer des testicules, et de nombreux cancers ont ou développent une immunité au médicament.
Le laboratoire de Lippard a modifié le cisplatine en remplaçant un ion chlorure par de la phénanthridine et a découvert que la nouvelle molécule se lie également à l'ADN. Au lieu de former des liens croisés, cependant, le phénanthriplatine se lie à un seul site mais bloque toujours la transcription.
En réalité, son laboratoire a découvert que le phénanthriplatine est jusqu'à 40 fois plus puissant que les platines traditionnels lorsqu'il est testé directement contre les cellules cancéreuses du poumon, Sein, os et autres tissus. La molécule semble également éviter les mécanismes de défense qui véhiculent la résistance.
Mais lorsqu'il est injecté dans des modèles murins de cancer, le candidat-médicament n'a pas fait mieux que les platines standard.
Lippard s'est rendu compte que le phénanthriplatine n'atteignait pas sa cible. Il avait un problème de livraison de drogue.
Il a trouvé une solution potentielle en visitant le campus de Case Western Reserve et a entendu Steinmetz expliquer son travail d'enquête sur le virus de la mosaïque du tabac (TMV) pour l'administration de médicaments il y a plus d'un an.
"J'ai imaginé que TMV serait le véhicule parfait, " a déclaré Lippard. " Nous avons donc bu une bière et formé une collaboration. "
Le long, les nanoparticules minces du virus de la mosaïque du tabac sont naturelles pour administrer le candidat médicament dans les tumeurs, dit Steinmetz, qui a été nommé par la Case Western Reserve School of Medicine.
Les particules virales, qui n'infectera pas les humains, sont creux. Un tube central d'environ 4 nanomètres de diamètre court le long de la coque et le revêtement porte une charge négative.
Le phénanthriplatine mesure environ 1 nanomètre de diamètre et, lorsqu'il est traité avec du nitrate d'argent, a une forte charge positive. Il pénètre facilement et se lie à la doublure centrale.
La forme allongée de la nanoparticule la fait dégringoler le long des bords des vaisseaux sanguins, restent inaperçus par les cellules immunitaires et traversent le système vasculaire qui fuit des tumeurs et s'accumulent à l'intérieur. Peu de tissus sains sont exposés au médicament toxique.
A l'intérieur des tumeurs, les nanoparticules se rassemblent à l'intérieur des compartiments lysosomal des cellules cancéreuses, où ils sont, en substance, digéré. Le pH est beaucoup plus bas que dans le sang circulant, Steinmetz a expliqué. La coquille se détériore et libère du phénanthriplatine.
L'enveloppe est décomposée en protéines et nettoyée par des processus cellulaires métaboliques ou naturels en une journée tandis que le candidat-médicament commence à bloquer la transcription, conduisant à de plus grandes quantités de mort cellulaire par apoptose que les platines de réticulation.
Les chercheurs affirment que l'administration du phénanthriplatine dans la tumeur a amélioré ses performances par rapport au cisplatine ou au phénanthriplatine libre.
Lippard et Steinmetz continuent de collaborer, étudier l'utilisation de ce système pour délivrer d'autres médicaments ou candidats-médicaments, utilisation dans d'autres types de cancers, l'ajout d'agents à l'extérieur de la coquille pour augmenter l'accumulation à l'intérieur des tumeurs et plus encore.