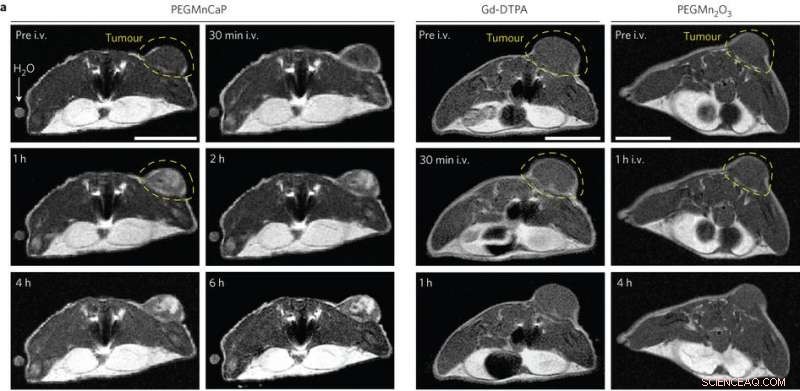
Images IRM in vivo de souris porteuses de tumeurs C26 sous-cutanées avant et après injection intraveineuse (i.v.) de PEGMnCaP (à gauche), Gd-DTPA (au centre) et PEGMn2O3 (à droite) mesurés par IRM 1 T. Seul le PEGMnCaP a montré une amélioration sélective et élevée du contraste tumoral. Barre d'échelle, 1 cm. Crédit :(c) Peng Mi et al, Nature Nanotechnologie (2016). DOI :10.1038/nnano.2016.72
(Phys.org) - Un nouveau type d'agent de contraste IRM à base de nanoparticules démontre la sélectivité des cellules tumorales par rapport aux cellules non cancéreuses, peut détecter l'hypoxie, et est suffisamment sensible pour permettre la détection de cellules cancéreuses difficiles à trouver selon une étude réalisée en Nature Nanotechnologie .
Des chercheurs de l'Université de Tokyo, Institut de technologie de Tokyo, Institut de promotion de l'industrie Kawasaki, et l'Agence japonaise pour la science et la technologie quantiques et radiologiques ont développé un agent de contraste à partir de nanoparticules à base de phosphate de calcium qui libèrent un ion manganèse dans un environnement acide. L'ion manganèse se lie ensuite aux protéines, ce qui permet un signal de contraste plus fort qui dure plus longtemps que les alternatives actuellement approuvées cliniquement. Ces agents de contraste à base de nanoparticules sont également fonctionnalisés avec une coque en poly(éthylène glycol) qui favorise l'attachement à la cellule cancéreuse.
L'imagerie par résonance magnétique repose sur l'excitation et la relaxation subséquente des protons. Dans les études cliniques d'IRM, le signal est déterminé par le temps de relaxation des protons d'hydrogène dans l'eau. Pour obtenir un signal plus fort, les scientifiques peuvent utiliser des agents de contraste pour raccourcir le temps de relaxation des protons.
L'IRM est non invasive et n'implique pas de rayonnement, ce qui en fait un outil de diagnostic sûr. Cependant, son signal faible rend la détection des tumeurs difficile. L'agent de contraste idéal sélectionnerait pour les tumeurs malignes, rendant sa localisation et son diagnostic beaucoup plus évidents.
Les agents de contraste à nanoparticules ont été intéressants car les nanoparticules peuvent être fonctionnalisées et, comme dans cette étude, peut contenir divers métaux. Des chercheurs ont tenté de fonctionnaliser des nanoparticules avec des ligands qui se fixent à des facteurs chimiques à la surface des cellules cancéreuses. Cependant, les cellules cancéreuses ont tendance à être hétérogènes du point de vue de la composition, conduisant certains chercheurs à rechercher des nanoparticules qui répondent aux différences de pH ou de potentiel redox par rapport aux cellules normales.
Peng Mi, Daisuke Kokuryo, Horacio Cabral, Hailiang Wu, Yasuko Terada, Tsuneo Saga, Ichio Aoki, Nobuhiro Nishiyama, et Kazunori Kataoka ont développé un agent de contraste composé de Mn 2+ - des nanoparticules de CaP dopées avec une coque en PEG. Ils ont estimé qu'en utilisant des nanoparticules de CaP, qui sont connus pour être sensibles au pH, permettrait la libération ciblée de Mn 2+ ions dans le microenvironnement tumoral. Le microenvironnement tumoral a tendance à avoir un pH inférieur à celui des régions normales pour accélérer le métabolisme cellulaire dans un environnement appauvri en oxygène. Les ions manganèse ont été testés car ils sont paramagnétiques, ce qui en fait un bon agent de contraste. Ils se lient également aux protéines créant un système manganèse-protéine à rotation lente qui se traduit par une nette amélioration du contraste.
Des études avec des nanoparticules de CaPMnPEG ont montré que les nanoparticules sont stables dans des conditions physiologiques (pH 7,4) et seulement 8% du Mn 2+ des ions ont été libérés dans ces conditions. Dans des conditions qui imitent le microenvironnement tumoral et l'environnement intercellulaire, dans les quatre heures 36% du Mn 2+ des ions ont été libérés à pH 6,7, 71% à pH 6,5, et plus de 90 % à pH 5.
En outre, des tests avec CaPMnPEG et l'albumine sérique humaine (HSA) en milieu acide ont montré une amplification significative du signal. Ceci est dû à la liaison aux protéines du Mn 2+ ion, ce qui a considérablement augmenté la relaxivité moléculaire de l'ion.
Ces résultats étaient prometteurs, alors Peng Mi, et al. puis testé si l'agent de contraste CaPMnPEG fonctionnait dans les tumeurs solides. Parce que Mn
2+
reste confiné dans la matrice nanoparticulaire à pH physiologique, CaPMnPEG démontre une toxicité beaucoup plus faible par rapport au MnCl
Des études IRM tridimensionnelles de tumeurs solides ont montré que sans l'ajout de CaPMnPEG, seuls les vaisseaux sanguins étaient visibles. Cependant, lors de l'ajout de CaPMnPEG, la tumeur était facilement distinguable. En outre, il est prouvé que l'excès de Mn 2+ quitte le plasma au bout d'une heure. Le signal de contraste est resté fort pendant plusieurs heures indiquant que la liaison aux protéines plutôt que Mn 2+ la concentration est importante pour l'amélioration du signal.
Notamment, il y avait des régions d'amélioration de contraste plus lumineuses sur la tumeur. Des expériences supplémentaires ont démontré que les régions à contraste plus élevé étaient corrélées à l'hypoxie tumorale. Les tumeurs malignes ont tendance à être hypoxiques, ce qui entraîne une accumulation de lactate. Cela entraîne une baisse du pH. D'autres techniques pour détecter l'hypoxie ont tendance à ne regarder que la surface du tissu cible ou, dans le cas du PET, impliquent des radiations et une mauvaise résolution. Cette technique est plus sûre, non invasif, et ne se limite pas aux tumeurs de surface.
Finalement, des tests avec des tumeurs métastatiques dans le foie (cellules cancéreuses du côlon C26) ont montré que CaPMnPEG fonctionne bien dans l'analyse d'organes solides et est très sensible pour détecter des micrométastases de taille millimétrique. Contrairement aux autres agents de contraste utilisés en clinique, CaPMnPEG a fourni un signal de contraste qui a duré plusieurs heures après l'injection. Après une heure, le signal était amélioré de 25 % et après deux heures, le signal a été amélioré de 39 %.
Cette recherche rapporte le développement et la caractérisation d'un nouvel agent de contraste prometteur qui pourrait permettre une meilleure détection et un meilleur diagnostic des tumeurs. Des études supplémentaires pourraient impliquer de tester cet agent de contraste avec d'autres maladies qui provoquent des changements physiologiques du pH ainsi que la surveillance in vivo de nouveaux médicaments.
© 2016 Phys.org