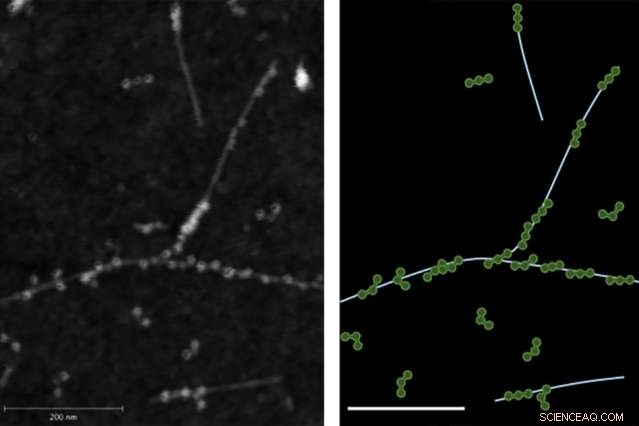
L'image de microscopie à force atomique (AFM) sur la gauche démontre la liaison physique entre les protéines de fibrinogène et les nanotubes de carbone à paroi unique. La droite montre une trace de l'image AFM avec le fibrinogène en vert et les nanotubes en bleu clair.
À l'aide de nanotubes de carbone, Les ingénieurs chimistes du MIT ont mis au point une nouvelle méthode de détection des protéines, dont le fibrinogène, l'un des facteurs de coagulation essentiels à la cascade de la coagulation sanguine.
Cette approche, s'il est développé en un capteur implantable, pourrait être utile pour le suivi des patients qui prennent des anticoagulants, permettant aux médecins de s'assurer que les médicaments n'interfèrent pas trop avec la coagulation du sang.
La nouvelle méthode est la première à créer des sites de reconnaissance synthétiques (similaires aux anticorps naturels) pour les protéines et à les coupler directement à un nanocapteur puissant tel qu'un nanotube de carbone. Les chercheurs ont également fait des progrès significatifs sur un site de reconnaissance similaire pour l'insuline, qui pourrait permettre un meilleur suivi des patients diabétiques. Il peut également être possible d'utiliser cette approche pour détecter des protéines associées au cancer ou aux maladies cardiaques, dit Michael Strano, le professeur Carbon P. Dubbs en génie chimique au MIT.
Strano est l'auteur principal d'un article décrivant la méthode dans Nature Communications. Gili Bisker, un post-doctorant dans le laboratoire de Strano, est l'auteur principal de l'article.
Une recherche ciblée
Le nouveau capteur est le dernier exemple d'une méthode développée dans le laboratoire de Strano, connue sous le nom de Reconnaissance Moléculaire en Phase Corona (CoPhMoRe).

Cette image de microscopie électronique à balayage montre des nanotubes de carbone à paroi simple, la matière première utilisée par les chercheurs.
Cette technique tire parti des interactions entre un polymère donné et une surface de nanoparticule telle que celle d'un nanotube de carbone monoparoi fluorescent, lorsque le polymère est enroulé autour du nanotube.
Certaines régions des polymères s'accrochent à la surface des nanoparticules comme des ancres, tandis que d'autres régions s'étendent vers l'extérieur dans leur environnement. Cette région tournée vers l'extérieur, également appelée phase adsorbée ou couronne, a une structure 3-D qui dépend de la composition du polymère.
CoPhMoRe fonctionne lorsqu'un polymère spécifique s'adsorbe à la surface des nanoparticules et crée une couronne qui reconnaît la molécule cible. Ces interactions sont très spécifiques, tout comme la liaison entre un anticorps et sa cible. La fixation de la cible altère la fluorescence naturelle des nanotubes de carbone, permettant aux chercheurs de mesurer la quantité de molécule cible présente.
Le laboratoire de Strano a déjà utilisé cette approche pour trouver des sites de reconnaissance et développer des nanocapteurs pour l'œstradiol et la riboflavine, entre autres molécules. Le nouvel article représente leur première tentative d'identification des phases corona capables de détecter des protéines, qui sont plus gros, plus complexe, et plus fragiles que les molécules identifiées par leurs précédents capteurs.
Pour cette étude, Bisker a commencé par cribler des nanotubes de carbone enveloppés dans 20 polymères différents dont l'ADN, ARN, et le polyéthylène glycol (PEG), un polymère souvent ajouté aux médicaments pour augmenter leur longévité dans le sang.
Par eux-même, aucun des polymères n'avait d'affinité pour les 14 protéines testées, tous prélevés sur du sang humain. Cependant, lorsque les chercheurs ont testé des nanotubes enveloppés de polymère contre les mêmes protéines, ils ont trouvé une correspondance entre l'un des nanotubes modifiés et le fibrinogène.
"Un chimiste ou un biologiste ne serait pas en mesure de prédire à l'avance qu'il devrait y avoir une quelconque affinité entre le fibrinogène et cette phase corona, " dit Strano. " C'est vraiment un nouveau type de reconnaissance moléculaire. "
Fibrinogène, l'une des protéines les plus abondantes dans le sang humain, fait partie de la cascade de la coagulation sanguine. Lorsqu'un vaisseau sanguin est endommagé, une enzyme appelée thrombine convertit le fibrinogène en fibrine, une protéine filandreuse qui forme des caillots pour sceller la plaie.
Un capteur de fibrinogène pourrait aider les médecins à déterminer si les patients qui prennent des anticoagulants ont encore une capacité de coagulation suffisante pour les protéger des blessures, et pourrait permettre aux médecins de calculer des dosages plus finement ajustés. Il pourrait également être utilisé pour tester la coagulation du sang des patients avant leur intervention chirurgicale, ou pour surveiller la cicatrisation des plaies, dit Bisker.
Anticorps synthétiques
Les chercheurs pensent que leurs agents synthétiques de reconnaissance moléculaire sont une amélioration par rapport aux systèmes naturels existants basés sur des anticorps ou des séquences d'ADN appelées aptamères, qui sont plus fragiles et ont tendance à se dégrader avec le temps.
"L'un des avantages de ceci est qu'il s'agit d'un système entièrement synthétique qui peut avoir une durée de vie beaucoup plus longue dans le corps, " dit Bisker.
En 2013, des chercheurs du laboratoire de Strano ont démontré que les capteurs à nanotubes de carbone peuvent rester actifs chez la souris pendant plus d'un an après avoir été intégrés dans un gel polymère et implantés chirurgicalement sous la peau.
En plus de l'insuline, les chercheurs s'intéressent également à la détection de la troponine, une protéine qui est libérée par les cellules cardiaques mourantes, ou détecter des protéines associées au cancer, ce qui serait utile pour surveiller le succès de la chimiothérapie. Ces capteurs et d'autres protéines pourraient devenir des composants essentiels des dispositifs qui délivrent des médicaments en réponse à un signe de maladie.
"En mesurant des marqueurs thérapeutiques dans le corps humain en temps réel, nous pouvons mettre en place des systèmes d'administration de médicaments beaucoup plus intelligents, et libérer des médicaments en quantités précises, " dit Strano. " Cependant, la mesure de ces biomarqueurs est la première étape."