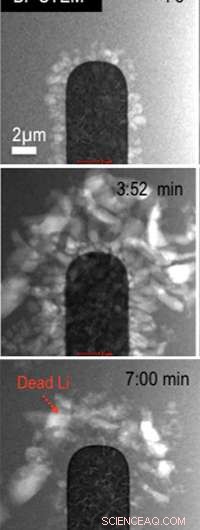
Lithium déposé sur l'anode en platine au départ (en haut), pendant (au milieu) et à la fin (en bas) du deuxième cycle. Des résidus de « lithium mort » peuvent être observés sur et autour de l'anode.
Utilisé dans tout, des véhicules électriques aux ordinateurs portables, la batterie lithium est omniprésente, mais il n'est pas bien compris à l'échelle atomique. Pour voir ce qui se passe à l'échelle nanométrique, les scientifiques du Centre commun de recherche sur le stockage de l'énergie (JCESR) du DOE ont conçu et mis en œuvre un petit appareil, connu sous le nom d'étape électrochimique operando. En utilisant cette étape à l'intérieur d'un microscope électronique à transmission à correction d'aberration de pointe, ils peuvent prendre des images à résolution nanométrique des ions lithium lorsqu'ils se déposent ou se dissolvent sur une électrode pendant que la batterie fonctionne.
Avec la nouvelle scène, les scientifiques peuvent directement visualiser les changements au fur et à mesure qu'ils se produisent. Les nouvelles images permettent des mesures et des descriptions précises de ce qui se passe à l'intérieur de la batterie. Ces informations sont vitales pour contrôler les processus limitant les performances et la sécurité. Maintenant, les scientifiques peuvent rapidement visualiser et tester de nouveaux appariements d'électrodes et d'électrolytes (voir Batterie 101). La nouvelle étape aidera à trier rapidement les options pour une durée plus longue, batteries plus sûres.
Aller au-delà de la batterie lithium-ion standard actuelle de l'industrie a été difficile. Dans le lithium-air et d'autres conceptions, les interactions aux interfaces électrode-électrolyte affectent les performances et la sécurité de la batterie. Pour comprendre les réactions, scientifiques du Pacific Northwest National Laboratory, dans le cadre du JCESR, créé une étape électrochimique operando. En l'utilisant dans un microscope électronique à balayage à transmission à correction d'aberration, les scientifiques peuvent désormais imager chimiquement l'interface entre l'anode en platine et l'électrolyte pendant le fonctionnement de la batterie.
La méthode d'imagerie met en évidence du lithium métal solide, l'identifiant de manière unique parmi les composants qui composent la couche protectrice d'interphase d'électrolyte solide. En utilisant ces images et les données électrochimiques standards, les scientifiques peuvent quantifier, à l'échelle nanométrique, la quantité de lithium qui finit par se déposer de manière irréversible après chaque cycle de charge/décharge. Cela signifie qu'ils peuvent voir les dendrites - les épines microscopiques qui provoquent la défaillance des batteries - au fur et à mesure qu'elles se forment.
La technique montre également la croissance de la couche d'interphase solide-électrolyte, qui enveloppe et protège l'anode. La couche est formée à la suite de la décomposition de l'électrolyte. Dans leurs études, l'équipe a découvert que le cycle prolongé de la batterie conduit à la croissance du lithium sous la couche - la genèse des dendrites qui ont des implications pour la sécurité et les performances de la batterie.
Ce nouvel outil d'imagerie ouvre des possibilités pour visualiser et tester rapidement les paires électrode/électrolyte pour les nouveaux systèmes de batterie. Ces systèmes pourraient permettre aux voitures électriques de parcourir de grandes distances entre les charges. Aussi, un jour, de tels systèmes pourraient stocker l'énergie des stations éoliennes et solaires, rendre l'énergie intermittente disponible en cas de besoin.
Batterie 101
La plupart des batteries rechargeables utilisées aujourd'hui sont des batteries lithium-ion, qui ont deux électrodes :une chargée positivement et contenant du lithium et une autre, négatif qui est généralement fait de graphite. L'électricité est générée lorsque les électrons circulent à travers un fil qui relie les deux. Pour contrôler les électrons, les atomes de lithium chargés positivement passent d'une électrode à l'autre par un autre chemin :la solution d'électrolyte dans laquelle reposent les électrodes. Mais le graphite a une faible capacité de stockage d'énergie, limiter la quantité d'énergie qu'une batterie lithium-ion peut fournir aux téléphones intelligents et aux véhicules électriques.
Lorsque les batteries rechargeables à base de lithium ont été développées pour la première fois dans les années 1970, les chercheurs ont utilisé du lithium pour l'électrode négative, qui est également connu comme une anode. Le lithium a été choisi car il a une capacité de stockage d'énergie dix fois supérieure à celle du graphite. Le problème était, l'électrolyte porteur de lithium a réagi avec l'anode de lithium. Cela a provoqué la croissance de dendrites de lithium microscopiques et la défaillance des premières batteries.
Beaucoup ont modifié les batteries rechargeables au fil des ans pour tenter de résoudre le problème des dendrites. Au début des années 1990, les chercheurs sont passés à d'autres matériaux comme le graphite pour l'anode. Plus récemment, les scientifiques ont également recouvert l'anode d'une couche protectrice, tandis que d'autres ont créé des additifs électrolytiques. Certaines solutions ont éliminé les dendrites, mais a également entraîné des batteries peu pratiques avec peu de puissance. D'autres méthodes n'ont fait que ralentir, mais ne s'est pas arrêté, la croissance de la fibre.