Cartographie d'épitopes de liaison de nanocorps sur GFP par RMN. Crédit :(c) Méthodes naturelles , DOI :10.1038/nmeth.3170
Anticorps, en charge de la reconnaissance et du homing sur des cibles moléculaires, sont parmi les outils les plus utiles en biologie et en médecine. Les nanobodies - les petits cousins des anticorps - peuvent faire les mêmes tâches, par exemple, marquer des molécules pour la recherche ou signaler des cellules malades en vue de leur destruction. Mais, grâce à leur simplicité relative, les nanocorps offrent la perspective alléchante d'être beaucoup plus faciles à produire.
Malheureusement, leur promesse n'a pas été pleinement réalisée, parce que les scientifiques manquaient d'un moyen efficace d'identifier les nanocorps les plus étroitement liés à leurs cibles. Cependant, un nouveau système, développé par des chercheurs de l'Université Rockefeller et leurs collaborateurs et décrit aujourd'hui dans Méthodes naturelles , promet de rendre les nanocorps considérablement plus accessibles pour toutes sortes de recherches.
Les anticorps sont des protéines défensives déployées par le système immunitaire pour identifier et neutraliser les envahisseurs. Mais leur pouvoir peut également être exploité d'autres manières, et ils sont utilisés en biologie et en médecine pour visualiser les processus cellulaires, attaquant les cellules malades et délivrant des molécules spécifiques à des endroits spécifiques. Comme leurs grands cousins, Les nanobodies peuvent également être utilisés pour ces tâches, mais leur petite taille rend les nanobodies beaucoup plus faciles à cultiver dans les usines bactériennes. Ils peuvent également accéder à des endroits difficiles d'accès qui peuvent être interdits aux molécules plus grosses.
"Les nanobodies ont un potentiel énorme en tant qu'alternatives polyvalentes et accessibles aux anticorps conventionnels, mais malheureusement les techniques actuelles présentent un goulot d'étranglement pour répondre à la demande, " dit l'auteur de l'étude Michael Rout, directeur du Laboratoire de biologie cellulaire et structurale de Rockefeller. "Nous espérons que notre système rendra plus disponibles les nanocorps à haute affinité, et leur ouvrir de nombreuses nouvelles utilisations possibles."
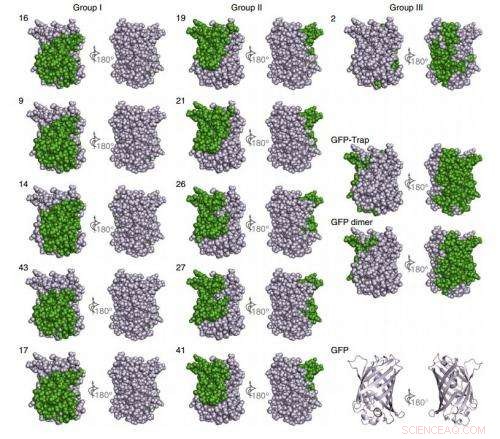
Dans leurs premières études, l'équipe a généré des anticorps de haute affinité, ceux qui sont capables de se lier le plus précisément à leurs cibles, dirigé contre deux protéines fluorescentes que les biologistes utilisent souvent comme marqueurs pour visualiser l'activité au sein des cellules :GFP et mCherry. Leur nouveau système, comme celles existantes pour générer des anticorps, commence par un animal, dans ce cas, des lamas hébergés dans un établissement du Connecticut.
Les lamas ont été choisis parce que les variantes d'anticorps qu'ils produisent sont facilement modifiées pour générer des nanocorps, qui ne représentent qu'un dixième du poids d'un anticorps ordinaire. Les lamas ont été immunisés avec GFP et mCherry, incitant leur système immunitaire à générer des anticorps contre ces protéines étrangères.
"La clé était de trouver un moyen relativement rapide de déterminer les séquences génétiques des anticorps qui se lient aux cibles avec la plus grande affinité. Jusqu'à présent, l'obtention de ces séquences de haute affinité était une sorte de Saint Graal, " dit Brian Chait, Camille et Henry Dreyfus Professeur et responsable du Laboratoire de spectrométrie de masse et de chimie des ions gazeux à Rockefeller. "Une fois ces séquences obtenues, il est facile de concevoir des bactéries pour produire en masse les anticorps. »
Les chercheurs, dirigé par l'étudiant diplômé Peter Fridy et le postdoctorant Yinyin Li, a commencé par créer des bases de données de séquences d'anticorps à partir d'ARN isolé de cellules productrices d'anticorps dans la moelle osseuse des lamas. Prochain, ils ont sélectionné les anticorps GFP et mCherry à liaison la plus étroite à partir d'échantillons de sang provenant des mêmes lamas, et coupez-les chimiquement en plus petits morceaux, en ne gardant que la section de liaison à l'antigène pour créer des nanocorps.
Ils ont ensuite déterminé des séquences partielles des acides aminés qui constituaient la protéine des nanocorps avec une technique connue sous le nom de spectrométrie de masse. À l'aide d'un algorithme informatique appelé « magie du lama, " développé par David Fenyö et Sarah Keegan de la New York University School of Medicine, ils ont fait correspondre la composition des nanocorps de la plus haute affinité avec la séquence d'ARN d'origine. Avec cette séquence, ils pourraient concevoir des bactéries pour produire en masse les nanocorps avant de les utiliser dans des expériences.
Les anticorps sont souvent utilisés pour isoler une structure particulière dans une cellule afin que les scientifiques puissent la retirer et l'examiner, et c'est exactement ce que l'équipe a fait avec ses nouveaux nanobodies. Ils ont purifié diverses structures cellulaires marquées avec GFP ou mCherry, et aussi visualisé ces structures in situ.
En tout, leur procédure a généré 25 types de nanobodies capables de cibler précisément la GFP et six pour mCherry, un ensemble beaucoup plus diversifié de nanocorps à haute affinité que ce qui est généralement possible avec les techniques conventionnelles.
Cette abondance ouvre de nouvelles options. Les scientifiques ne peuvent sélectionner que les meilleurs, éliminer les nanocorps qui, par hasard, réagissent de manière croisée avec d'autres molécules, ou enchaîner deux nanocorps qui se fixent à des points différents sur la même molécule cible pour générer un dimère à très haute affinité, exactement comme les chercheurs l'ont démontré pour les nanobodies GFP. Cette très haute affinité pourrait être une caractéristique puissante lors de la délivrance de molécules thérapeutiques ou diagnostiques, car elle réduirait le dosage requis, et ainsi réduire les effets secondaires indésirables.
"Étant donné que nous pouvons maintenant identifier facilement des suites de nanocorps à haute affinité, l'avenir pour eux en tant qu'outils de recherche, diagnostic et thérapeutique semble brillant, " dit Rout.