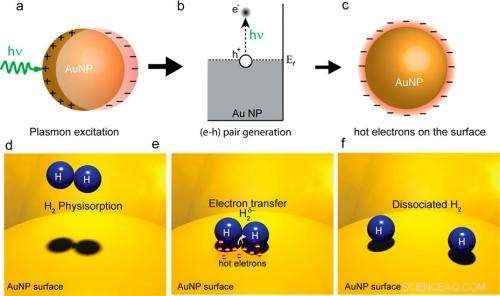
Dans un), (b), et C), des plasmons de surface excités par un laser génèrent des électrons chauds sur une surface de nanoparticules d'or. En (d), (e), et (f), les électrons chauds se transfèrent aux molécules H2 et provoquent leur dissociation. Puisque la dissociation est l'étape limitante dans de nombreuses réactions chimiques, ce processus d'électrons chauds peut augmenter l'efficacité de la réaction. Crédit image :Shaunak Mukherjee, et al. ©2012 Société chimique américaine
(Phys.org)—Du raffinage du pétrole à la transformation des aliments, la grande majorité des applications chimiques commerciales impliquent des catalyseurs pour contrôler la vitesse des réactions chimiques. Tout ce qui peut augmenter l'efficacité des catalyseurs pourrait avoir un impact généralisé dans ces domaines. Dans une nouvelle étude, les scientifiques ont montré qu'une amélioration de l'efficacité peut être possible en créant des électrons "chauds" (ceux à très haute énergie) à partir d'une surface métallique sur laquelle se produit la réaction chimique, et en utilisant les électrons pour contrôler la réaction chimique et la rendre plus efficace.
Les chercheurs, dirigé par les professeurs Peter Nordlander et Naomi J. Halas de l'Université Rice à Houston, Texas, et le professeur Emily A. Carter de l'Université de Princeton, New Jersey, ont publié leur étude sur la technique pour améliorer la chimie catalytique dans un récent numéro de Lettres nano .
Dans leur méthode, les chercheurs ont utilisé un laser à lumière visible pour illuminer une surface de nanoparticules d'or (la surface du catalyseur) à température ambiante. La lumière laser entrante excite optiquement les plasmons de surface sur la surface métallique, et les plasmons se désintègrent ensuite en électrons chauds. En raison de leurs hautes énergies, les électrons chauds s'étendent plus loin des nanoparticules que ne le font les électrons de plus faible énergie. Si un autre atome ou molécule pouvant accepter l'électron se trouve à proximité, l'électron chaud peut se transférer dans les états électroniques de cet accepteur.
Dans ces expériences, les chercheurs ont adsorbé H
« Dans de nombreuses réactions chimiques importantes, l'étape limitant la vitesse est la dissociation de molécules à coque fermée comme une molécule d'hydrogène, " Nordlander a dit Phys.org . "Si cette étape de réaction peut être 'traitée' (en utilisant notre processus d'électrons chauds démontré), la réaction peut se dérouler beaucoup plus rapidement et nécessiter moins d'énergie."
Pour mesurer la dissociation, les chercheurs ont exposé le substrat de nanoparticules à la fois H
"Une molécule d'hydrogène adsorbée sur une surface d'or macroscopique ne se dissocie pas spontanément, même à des températures élevées, " Nordlander a déclaré. "C'est une réaction chimique impossible. L'énergie de dissociation est tout simplement trop grande. Nous avons choisi le système hydrogène-or exactement pour cette raison. Nous voulions un système où l'interprétation de l'effet soit simple. Sur d'autres métaux, comme les métaux de transition, une molécule d'hydrogène peut se dissocier spontanément, en particulier près des défauts et à des températures élevées. Mais pas sur l'or."
Ces résultats démontrent comment le domaine de la plasmonique – qui implique des interactions entre photons et nanostructures – peut avoir des applications dans le domaine de la chimie catalytique, en particulier la photocatalyse, Les chercheurs espèrent que cette démonstration de la capacité à contrôler les réactions chimiques à l'aide de la lumière pourra être étendue à des usages spécifiques. En utilisant la fréquence laser pour régler les résonances des plasmons de surface, il peut être possible de créer des électrons chauds avec des énergies spécifiques qui peuplent des états électroniques spécifiques de molécules adsorbées sur la surface des nanoparticules.
"L'application immédiate est d'améliorer l'efficacité des catalyseurs métalliques en les éclairant avec de la lumière, " Nordlander a déclaré. "Nos groupes ont un programme très "vert" et notre intention est de concevoir de nouveaux types de catalyseurs qui sont entraînés par la lumière du soleil. C'est quelque chose que nous avons en abondance ici à Houston.
"Une autre application importante est d'étudier dans quelle mesure nous pouvons diriger et contrôler les réactions chimiques en faisant transférer des électrons chauds d'énergies particulières dans des orbitales moléculaires spécifiques. C'est un sujet de recherche relativement inexploré. Les électrons normaux ont des énergies positives et sont beaucoup plus " chauds " que nos électrons chauds. De tels électrons à haute énergie ne restent généralement pas sur une molécule suffisamment longtemps pour que les atomes commencent à se déplacer.
Copyright 2012 Phys.org
Tous les droits sont réservés. Ce matériel ne peut pas être publié, diffuser, réécrit ou redistribué en tout ou en partie sans l'autorisation écrite expresse de Phys.org.