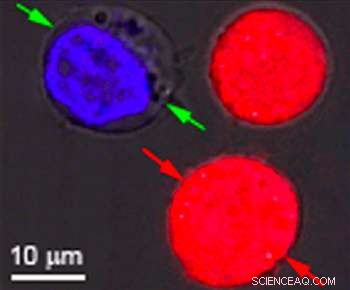
Des cellules identiques colorées en rouge et en bleu ont été la cible de recherches à l'Université Rice pour montrer l'effet des nanobulles plasmoniques. Les bulles se forment autour des nanoparticules d'or chauffées qui ciblent des cellules particulières, comme les cellules cancéreuses. Lorsque les particules sont creuses, des bulles se forment qui sont assez grosses pour tuer la cellule lorsqu'elles éclatent. Lorsque les particules sont solides, les bulles sont plus petites et peuvent percer un trou temporaire dans une paroi cellulaire, permettant aux médicaments ou à d'autres matériaux de s'écouler. Les deux effets peuvent être obtenus simultanément avec une seule impulsion laser. Crédit :Plasmonic Nanobubble Lab/Rice University
(Phys.org) - Des chercheurs de l'Université Rice ont trouvé un moyen de tuer certaines cellules malades et d'en traiter d'autres dans le même échantillon en même temps. Le processus activé par une impulsion de lumière laser laisse intactes les cellules saines voisines.
L'utilisation unique des nanobulles plasmoniques accordables développées dans le laboratoire Rice de Dmitri Lapotko semble prometteuse de remplacer plusieurs processus difficiles maintenant utilisés pour traiter les patients atteints de cancer, entre autres, avec un jeûne, Facile, procédure multifonctionnelle.
La recherche est au centre d'un article publié en ligne cette semaine par la revue American Chemical Society ACS Nano et a été réalisée à Rice par Lapotko, chercheur et auteur principal Ekaterina Lukianova-Hleb et étudiant de premier cycle Martin Matonga, avec l'aide du Center for Cell and Gene Therapy du Baylor College of Medicine (BCM), Texas Children's Hospital et l'Université du Texas MD Anderson Cancer Center.
Nanobulles plasmoniques au nombre de 10, 000 fois plus petit qu'un cheveu humain provoque de minuscules explosions. Les bulles se forment autour des nanoparticules d'or plasmoniques qui se réchauffent lorsqu'elles sont excitées par une source d'énergie extérieure - dans ce cas, une courte impulsion laser – et vaporiser une fine couche de liquide près de la surface de la particule. La bulle de vapeur se dilate et s'effondre rapidement. Lapotko et ses collègues avaient déjà découvert que les nanobulles plasmoniques tuent les cellules cancéreuses en les faisant littéralement exploser sans endommager les voisins sains, un processus qui a montré une précision et une sélectivité beaucoup plus élevées par rapport à celles médiées par les nanoparticules d'or seules, il a dit.
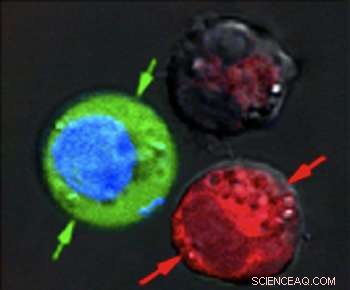
Après l'impulsion laser, les cellules colorées en rouge montrent des signes de dommages massifs causés par l'explosion de nanobulles, tandis que les cellules colorées en bleu sont restées intactes, mais avec un colorant fluorescent vert tiré de l'extérieur. Crédit :Plasmonic Nanobubble Lab/Rice University
Le nouveau projet va encore plus loin avec cette capacité remarquable. Une série d'expériences a prouvé qu'une seule impulsion laser crée de grandes nanobulles plasmoniques autour de nanocoquilles d'or creuses, et ces grosses nanobulles détruisent sélectivement les cellules indésirables. La même impulsion laser crée des nanobulles plus petites autour de nanosphères d'or massif qui perforent une minuscule, pore temporaire dans la paroi d'une cellule et créent un nanojet entrant qui "injecte" rapidement des médicaments ou des gènes dans les autres cellules.
Dans leurs expériences, Lapotko et son équipe ont placé des nanocoquilles creuses de 60 nanomètres de large dans des cellules cancéreuses modèles et les ont colorées en rouge. Dans un lot séparé, ils ont placé des nanosphères de 60 nanomètres de large dans le même type de cellules et les ont colorées en bleu.
Après avoir suspendu les cellules ensemble dans un colorant fluorescent vert, ils ont tiré une seule impulsion laser large sur l'échantillon combiné, lavé la tache verte et vérifié les cellules au microscope. Les globules rouges avec les nanocoquilles creuses ont été détruits par de grandes nanobulles plasmoniques. Les cellules bleues étaient intactes, mais un liquide teinté de vert de l'extérieur avait été aspiré dans les cellules où de plus petites nanobulles plasmoniques autour des nanoparticules d'or solides ont temporairement ouvert les parois.
Parce que tout cela se passe en une fraction de seconde, jusqu'à 10 milliards de cellules par minute pourraient être traitées sélectivement dans un système à flux continu comme celui en cours de développement chez Rice, dit Lapotko, membre du corps professoral en biochimie et biologie cellulaire et en physique et astronomie. Cela a le potentiel de faire progresser la thérapie cellulaire et génique et la transplantation de moelle osseuse, il a dit.
La plupart des thérapies cellulaires et géniques de lutte contre les maladies nécessitent un traitement « ex vivo » – à l'extérieur du corps – de greffes de cellules humaines pour éliminer les cellules indésirables (comme les cellules cancéreuses) et pour modifier génétiquement d'autres cellules pour augmenter leur efficacité thérapeutique, dit Lapotko. « Le traitement actuel des cellules est souvent lent, coûteux et exigeant en main-d'œuvre et souffre de pertes de cellules élevées et d'une mauvaise sélectivité. Idéalement, l'élimination et la transfection (l'introduction de matériaux dans les cellules) devraient être très efficaces, sélectif, rapide et sûr."
La technologie des nanobulles plasmoniques promet « une méthode permettant de faire plusieurs choses à une population cellulaire en même temps, " a déclaré Malcolm Brenner, professeur de médecine et de pédiatrie au BCM et directeur du Centre de thérapie cellulaire et génique du BCM, qui collabore avec l'équipe Rice. "Par exemple, si je veux mettre quelque chose dans une cellule souche pour la transformer en un autre type de cellule, et en même temps tuent les cellules environnantes qui ont le potentiel de faire du mal lorsqu'elles retournent chez un patient - ou chez un autre patient - ces nanobulles plasmoniques très accordables ont le potentiel de le faire. "
L'objectif à long terme d'un effort de collaboration entre Rice, BCM, Texas Children's Hospital et MD Anderson est d'améliorer les résultats pour les patients atteints de maladies dont le traitement nécessite un traitement cellulaire ex vivo, dit Lapotko.
Lapotko prévoit de construire un prototype de la technologie en vue de tester avec des cellules humaines dans un avenir proche. "Nous aimerions que ce soit une plateforme universelle pour la thérapie cellulaire et génique et pour la transplantation de cellules souches, " il a dit.