Couverture en ligne - un mésoscope miniature numérique (CM2). Crédit image :Xue et al., Avancées scientifiques, doi:10.1126/sciadv.abb7508
La photo de couverture de l'article en ligne sur Avancées scientifiques cette semaine affiche l'imagerie par fluorescence avec un mésoscope miniature informatique (CM 2 ). La technique de l'imagerie par fluorescence est un outil essentiel pour les biologistes et les neuroscientifiques; cependant, les microscopes conventionnels et les microscopes miniaturisés (miniscopes) sont contraints par un produit espace-bande passante limité - une mesure de la capacité d'information d'un système optique, faible profondeur de champ et une incapacité à résoudre les émetteurs distribués tridimensionnels (3-D). Pour dépasser les limites existantes, Yujia Xue et une équipe de chercheurs en génie électrique et informatique, la biologie, neurophotonique et génie biomédical à l'Université de Boston, NOUS., développé un mésoscope léger et compact connu sous le nom de mésoscope miniature computationnel (CM 2 ).
La nouvelle plate-forme a intégré une microlentille pour l'imagerie et un réseau de LED pour l'excitation au sein de la même configuration. L'appareil a effectué une imagerie 3-D en une seule prise et a facilité un gain de champ de vision de 10 fois et une amélioration de la profondeur de champ de 100 fois, par rapport aux miniscopes existants. Xue et al. testé l'appareil avec des billes et des fibres fluorescentes aux côtés d'expériences fantômes pour mesurer les effets de la diffusion en vrac et de la fluorescence de fond. L'équipe discute de l'utilité de ce mésoscope pour de larges applications en biomédecine et en enregistrement neuronal 3D.
Microscopie à fluorescence avancée
La microscopie à fluorescence est une technique clé en biologie fondamentale et en neurosciences des systèmes. Les récents développements technologiques visent à surmonter les barrières d'échelle pour étudier des neurones individuels de seulement quelques microns. Par exemple, macroscope, les microscopes mésolens et les microscopes à deux photons ont commencé à combler cette échelle; cependant, le développement de tels systèmes d'imagerie est limité par les aberrations géométriques dépendant de l'échelle des éléments optiques. Le champ de vision (FOV) réalisable est également limité par la faible profondeur de champ du système dans de nombreuses applications de bio-imagerie. Les chercheurs se concentrent également sur la miniaturisation de la technologie pour permettre l'imagerie in vivo chez des animaux se comportant librement. Par exemple, les microscopes miniaturisés appelés « miniscopes » ont obtenu un accès sans précédent aux signaux neuronaux, bien que les systèmes restent limités par leur optique, tout comme leurs homologues de microscopie à fluorescence. Xue et al. donc présenté et démontré un microscope miniature informatique (CM 2 ) à grande échelle, Mesures de fluorescence 3D sur un compact, plate-forme légère.
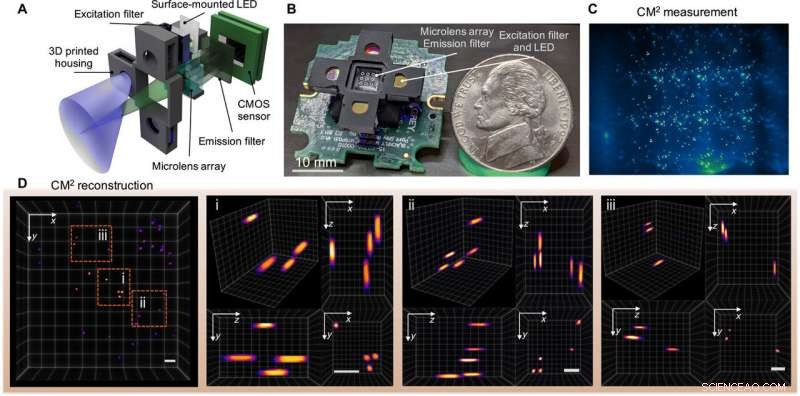
Fluorescence 3D monocoup CM2. (A) Le CM2 combine une optique MLA et une excitation de réseau de diodes électroluminescentes (LED) dans une plate-forme compacte et légère. (B) Photo du prototype CM2 (les fils électriques et le pilote du capteur sont omis). Crédit photo :Yujia Xue, Université de Boston. (C) Mesure CM2 sur des particules fluorescentes de 100 µm en suspension dans une résine transparente. (D) Vue projetée du volume reconstruit CM2 (7,0 mm par 7,3 mm par 2,5 mm) et trois régions de zoom avec des vues orthogonales. Barres d'échelle, 500 µm. CMOS, Oxyde métallique semi-conducteur complémentaire. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb7508 
L'équipe a utilisé une optique simple dans la configuration pour améliorer les produits à bande passante spatiale (SBP) et les capacités d'imagerie 3D sans avoir besoin d'un balayage mécanique. La technique a contourné les limites physiques de l'optique intégrée en concevant conjointement le matériel et l'algorithme. Le CM 2 méthode d'imagerie combinée plusieurs caractéristiques différentes de l'imagerie microscopique, comme l'imagerie intégrale, microscopie à champ lumineux et imagerie à ouverture codée. Dans son mécanisme d'action, le microscope a collecté une seule mesure 2D à l'aide d'un réseau de microlentilles (MLA) pour une reconstruction informatique ultérieure de la distribution de fluorescence 3D.
Le CM 2 a utilisé le réseau de microlentilles comme seul élément d'imagerie et a permis à la configuration de surmonter les limites du champ de vision (FOV) imposées par l'objectif des microscopes conventionnels. Le CM 2 L'algorithme a résolu le problème de déconvolution 2-D-to-3-D pour fournir des reconstructions résolues en profondeur. Xue et al. expliqué le principe du CM 2 capacité d'imagerie 3-D monocoup en faisant une analogie avec le multiplexage par répartition en fréquence (FDM). L'équipe a ensuite quantifié la résolution réalisable du CM 2 en calculant la fonction de transfert de modulation (MTF) 3-D du système et en analysant la résolution latérale.
Caractérisation du principe d'imagerie du CM2, écart de décalage, et résolution. (A) Le CM2 produit des PSF de réseau à variation axiale pour réaliser une section optique. Le cisaillement axial dans les foyers latéraux est bien caractérisé par le modèle géométrique présenté dans l'étude. Le PCC des PSF à balayage axial quantifie la résolution axiale attendue. EM, émission. (B) La MTF 3D (affichée à l'échelle logarithmique) montre que le CM2 capture des informations de fréquence axiale étendues et agrandit la SBP du système. Le support de la MTF expérimentale correspond à la théorie (en courbe en pointillés). L'angle de chaque « bande » inclinée dans la MTF est défini par l'emplacement angulaire de la microlentille αMLA correspondante (en pointillés). (C) La variance de décalage latéral est caractérisée par le PCC des PSF balayés latéralement. Le PSF dans le FOV central (marqué par des lignes de démarcation orange) contient 3 × 3 foyers ; le PSF dans le FOV externe (marqué par des lignes de délimitation bleues) contient 2 × 3 ou 3 × 2 foyers ; le PSF dans le FOV d'angle (marqué par des lignes de délimitation jaunes) contient 2 × 2 foyers. (D) La résolution dans différentes régions du champ de vision est caractérisée par la reconstruction d'un objet sténopé de 5 m à l'aide du modèle invariant de décalage du CM2. La pleine largeur latérale à mi-hauteur (FWHM) est systématiquement inférieure à 7 m. La FWHM axiale est de ~139 m dans le FOV central et se dégrade à ~172 et ~ 189 μm dans les FOV externe et d'angle, respectivement. (E) Géométrie pour l'imagerie d'une cible fluorescente inclinée. (F) Mesure CM2 brute. (G) MIP du volume reconstruit (8,1 mm par 5,5 mm par 1,8 mm). Les caractéristiques 7 µm (groupe 6, élément 2) peut être résolu comme indiqué dans la projection zoom avant xy. La capacité de sectionnement axial est caractérisée par la projection xz, valider la résolution axiale dépendante de la taille de la caractéristique. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb7508 
Xue et al. approximation de la formation de l'image du CM 2 configuration en utilisant un modèle invariant de décalage par tranche. Ils ont caractérisé la résolution et la variance de décalage latéral de la configuration avant l'imagerie expérimentale et ont imagé une cible de résolution fluorescente pour valider la résolution latérale du CM 2 . Ils ont validé les observations en utilisant des mesures simulées par Zemax pour trouver un bon accord entre les simulations et les expériences. La nouvelle plate-forme a permis aux scientifiques de localiser des émetteurs fluorescents répartis sur un grand volume. Ils ont testé les performances de CM 2 sur des échantillons avec une taille de caractéristique similaire à un seul neurone. Au cours de ces expériences, le CM 2 l'algorithme était tolérant aux dégradations du signal telles que des rapports signal/bruit réduits pour permettre une haute qualité, reconstruction en plein champ de vision. L'équipe a comparé le CM 2 reconstruction et un empilement axial acquis par un objectif pour démontrer la précision de la localisation monocoup de particules individuelles.
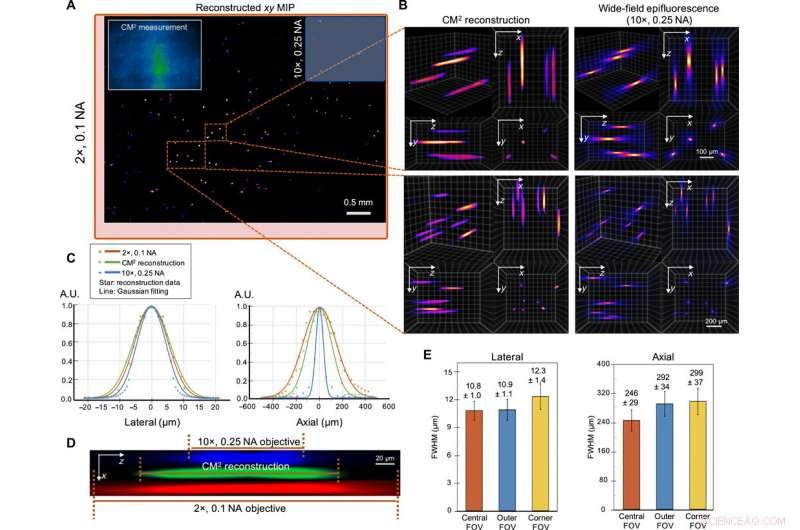
Imagerie 3D monocoup de particules fluorescentes de 10 µm dans un volume clair. (A) xy MIP du volume reconstruit couvrant 5,7 mm par 6,0 mm par 1,0 mm. Encart en haut à gauche :mesure CM2 brute. Le champ de vision du CM2 est comparable à celui d'un objectif 2× (boîte englobante rouge) et est ~25× plus large que l'objectif 10× (boîte englobante bleue). (B) Zoom avant de la reconstruction 3D CM2 référencée par le stack axial pris par un 10×, Objectif 0,25 NA. (C) Coupes transversales latérales et axiales de la particule récupérée de 10 µm. En comparant avec les mesures de la microscopie standard à fluorescence à grand champ, le CM2 récupère fidèlement le profil latéral de la particule et réalise une coupe en profondeur en un seul coup. A.U., unités arbitraires. (D) vue en coupe transversale xz d'une particule fluorescente reconstruite, par rapport à l'empilement axial acquis à partir des lentilles d'objectif 2× et 10×. (E) Caractériser les variations spatiales de la reconstruction, les statistiques des FWHM latérales et axiales des particules reconstruites sont tracées pour la centrale, extérieur, et FOV d'angle. La largeur latérale ne change que légèrement (~0,9%) dans le FOV externe mais augmente dans le FOV du coin (~13,9%). L'allongement axial se dégrade de ~246 m dans le FOV central à ~292 et ~ 299 μm dans les régions FOV externe et d'angle, respectivement. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb7508
Expériences sur des fibres fluorescentes sur une surface courbe et sur des fantômes à diffusion contrôlée.
Les scientifiques ont ensuite testé la capacité d'imager des échantillons fluorescents volumétriques complexes sur des fibres fluorescentes réparties sur une surface incurvée imprimée en 3D, imiter le profil de surface d'un cortex de souris, couvrant un large champ de vision et une profondeur étendue. L'algorithme a récupéré avec précision les structures au point et résolu pour l'objet 3D, tout en résolvant la plupart des fibres individuelles. L'équipe a en outre mené des expériences sur huit fantômes d'imagerie pour tester les performances de CM 2 sous diffusion massive et forte fluorescence de fond. Lors des expérimentations, ils ont ensemencé tous les fantômes avec la même concentration de particules fluorescentes cibles et ont attribué les différences de reconstruction à la diffusion en masse et à la fluorescence de fond. L'équipe a ensuite inclus des particules fluorescentes de fond de 1,1 µm pour imiter les sources fluorescentes insolubles couramment observées sur les échantillons biologiques; comme les neutrophiles dans le cerveau. Ils ont quantifié le niveau de diffusion pour chaque fantôme, effectué une reconstruction 3-D pour chaque fantôme de diffusion et effectué toutes les déconvolutions en utilisant le même paramètre de calcul. La plage de profondeur de reconstruction estimée variait avec les variations de surface présentes dans chaque fantôme.

Reconstruction de fibres fluorescentes. Le fichier vidéo visualise la reconstruction volumétrique de fibres fluorescentes sur une surface courbe. En comparaison, la carte de profondeur estimée à partir de l'empilement focal d'un microscope à épi-fluorescence grand champ avec un 2x, L'objectif 0,1 NA s'affiche. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb7508
De cette façon, Yujia Xue et ses collègues ont développé un nouveau système d'imagerie par fluorescence miniaturisé pour permettre une imagerie 3D mésoscopique à une seule prise. Le mésoscope miniature computationnel (CM 2 ) méthode d'imagerie de fluorescence intégrée et les modules d'excitation sur la même plate-forme compacte. L'équipe a présenté les simulations et les expériences pour établir le mécanisme d'action et la capacité d'imagerie 3D du CM 2 . Ils ont simulé l'imagerie à l'échelle du cerveau des réseaux vasculaires et les principaux résultats étaient prometteurs. Le CM 2 le prototype n'est pas encore comparable aux applications in vivo montées sur la tête (sur modèles animaux) dans les laboratoires de neurosciences, bien que l'équipe envisage d'optimiser le dispositif pour l'imagerie in vivo du cortex complet chez des souris se déplaçant librement. Le dispositif d'imagerie peut être encore amélioré avec de nouveaux développements dans le matériel et les algorithmes pour ouvrir de nouvelles opportunités passionnantes dans l'enregistrement neuronal in vivo et les applications biomédicales.
© 2020 Réseau Science X