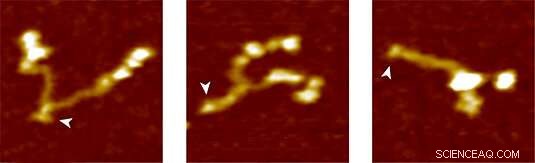
Protéine du facteur von Willebrand :complètement ouverte (à gauche), partiellement fermé et complètement fermé (à droite). Crédit :Groupe Lipfert
Les physiciens du LMU ont développé une méthode très sensible pour mesurer la stabilité mécanique des conformations des protéines, et l'a utilisé pour surveiller les premières étapes de la formation de caillots sanguins.
En tant que médiateurs centraux de la fonction cellulaire dans les organismes biologiques, les protéines sont impliquées dans l'exécution de pratiquement tous les processus cellulaires. Ils fournissent l'échafaudage interne qui donne aux cellules leur forme, et permettre aux cellules de modifier dynamiquement leur morphologie. Ils transportent les substrats dans les deux sens à travers les membranes, et ils catalysent la plupart des réactions chimiques qui ont lieu dans les cellules. Au cours de ces tâches, de nombreuses protéines sont soumises à des forces externes. En effet, certaines protéines « mécanosensibles » mesurent efficacement la force des forces agissant sur elles et sont activées lorsque la force imposée dépasse une valeur seuil donnée. Facteur de Von Willebrand (VWF), qui initie la formation de caillots sanguins, est un représentant important de cette classe.
Les forces mécaniques requises pour activer des protéines comme le VWF sont souvent si faibles que leur amplitude ne peut être déterminée à l'aide des méthodes existantes. Maintenant, une équipe de scientifiques dirigée par les physiciens du LMU, le Dr Martin Benoit et le professeur Jan Lipfert, a mis au point une procédure beaucoup plus sensible. Leurs "pinces magnétiques" peuvent quantifier des forces 100 fois inférieures à la méthode alternative couramment utilisée actuellement disponible. Comme Lipfert et ses collègues le rapportent dans le journal PNAS , ils ont utilisé la technique pour observer le déploiement de la protéine VWF sous l'influence de faibles forces mécaniques.
Une approche puissante pour étudier la mécanorégulation est la spectroscopie de force protéique. Cela implique de tirer sur une molécule de protéine individuelle et d'observer comment une force appliquée modifie sa structure tridimensionnelle. Jusqu'à maintenant, la méthode de choix pour tirer a été un microscope à force atomique, qui fonctionne le mieux dans la gamme de 100 piconewton (pN). "Toutefois, de nombreux processus moléculaires sont activés par des forces beaucoup plus faibles que cela, " dit Lipfert. " Donc pour les mesures au niveau de molécules simples, nous avons besoin d'instruments plus sensibles - il est inutile d'utiliser une balance de salle de bain pour peser les ingrédients d'un gâteau."
Les chercheurs ont développé une méthode dans laquelle les protéines sont attachées à une extrémité à une surface de verre et portent une étiquette à l'autre extrémité qui se lie à de minuscules billes magnétiques et l'assemblage est ensuite soumis à un champ magnétique externe. L'extension de la protéine induite par le champ se traduit par le déplacement vertical de chaque bille, qui peut être détecté par microscopie. "Ce type d'installation est appelé pince à épiler magnétique, " explique Lipfert. " Il a le grand avantage qu'il nous permet d'appliquer et de résoudre des forces très faibles - significativement moins de 1 piconewton - à la protéine d'intérêt. En outre, les pinces magnétiques permettent des mesures très stables sur de longues périodes de temps, jusqu'à une semaine."
Pour tester la nouvelle méthode, le groupe LMU a utilisé le VWF comme protéine cible. Dans la circulation sanguine, Le VWF circule sous la forme d'un multimère de dimères constitués de deux sous-unités identiques. Dans des conditions normales de circulation sanguine, il a une forme globulaire relativement compacte. Cependant, toute augmentation des forces de cisaillement dans la circulation sanguine due à une lésion du système vasculaire provoque le développement du vWF. Cela expose les sites de liaison des récepteurs sur les plaquettes sanguines. La liaison du VWF aux plaquettes déclenche à son tour une cascade de réactions qui conduit à la coagulation, qui scelle la plaie. "La cascade est induite par l'action sur la molécule de forces mécaniques agissant beaucoup plus faibles que celles qui ont été mesurées jusqu'à présent, " dit Lipfert. L'analyse de la décompression des dimères VWF avec des pincettes magnétiques a montré que la tige dite VWF s'ouvre sous une force appliquée inférieure à 1 pN, lorsque les sous-unités du dimère sont séparées comme les deux moitiés d'une fermeture éclair. "Nous supposons que ce modèle de comportement, que nous avons pu observer pour la première fois, représente la première étape de la coagulation sanguine, " dit Lipfert. "Notre approche fournit une image détaillée des forces et des changements d'extension impliqués dans le déploiement de la protéine. Nous sommes convaincus que l'application future de la méthode contribuera à une meilleure compréhension du mode d'action du VWF et du rôle des mutations cliniquement pertinentes.