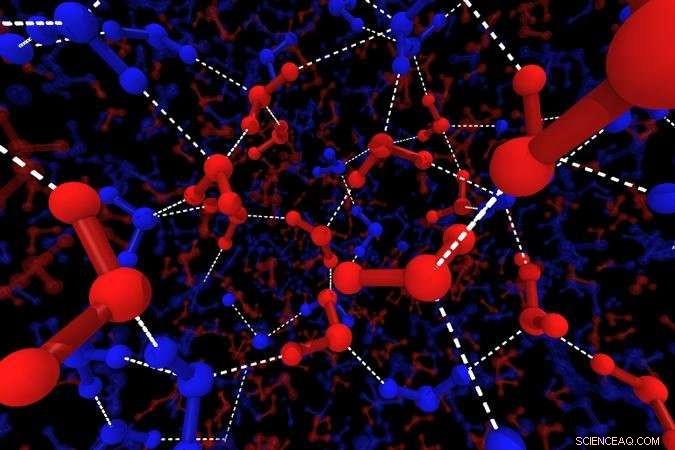
Illustration des structures locales de l'eau. Les lignes bleues montrent les molécules H2O de structure tétraédrique, les lignes rouges montrent des molécules H2O de structure désordonnée. Les grosses boules montrent des atomes d'oxygène, les petites boules montrent l'hydrogène et les lignes blanches en pointillés représentent les liaisons hydrogène. Crédit : 2018 Hajime Tanaka, Institut des sciences industrielles, L'Université de Tokyo
Une équipe de recherche japonaise dirigée par l'Université de Tokyo a étudié la transition fragile à forte de l'eau. Contrairement à la plupart des liquides, quand l'eau est refroidie, la vitesse d'augmentation de sa viscosité atteint un maximum à une certaine basse température. L'équipe a montré que la modélisation de l'eau en tant que mélange dépendant de la température de deux états - eau rapide désordonnée et eau lente localement ordonnée - expliquait la transition fragile à forte et évitait les prédictions erronées des théories antérieures basées sur le comportement vitreux.
L'eau est étrange à bien des égards. Certaines de ses bizarreries chimiques sont familières, comme l'expansion quand il gèle en glace. Une curiosité méconnue, qu'il partage avec quelques autres liquides, est la transition du fragile au fort. Expliquant ce comportement, qui se rapporte à la façon dont l'eau froide s'écoule, a longtemps été une source de débat. Maintenant, une explication convaincante a été avancée par des chercheurs de Tokyo.
Lorsque les liquides refroidissent, leur dynamique ralentit et ils deviennent visqueux. Pour la plupart des liquides, le taux de ralentissement est constant en fonction de la température et ceux-ci sont connus comme des liquides forts. Pour les liquides fragiles, cependant, le taux augmente continuellement à mesure que la température baisse. L'eau est inhabituelle à cet égard - elle est fragile à température ambiante, mais fort à basse température, où son taux d'augmentation de la viscosité atteint un pic.
Cette transition du fragile au fort est insaisissable, se produisant uniquement dans le régime de surfusion, au-dessous du point de congélation habituel de l'eau. Les premiers modèles ont essayé de le lier à la dynamique vitreuse, car l'eau surfondue est connue pour être un formateur de verre. Cependant, une équipe dirigée par l'Institut des sciences industrielles (IIS) de l'Université de Tokyo propose une théorie à deux états, en effet la modélisation de l'eau comme un mélange de deux liquides coexistants.
Mathématiquement, la distinction fort/fragile repose sur la loi d'Arrhenius pour les processus dynamiques - les liquides forts obéissent à cette loi, mais pour les fragiles, l'augmentation rapide de la viscosité est super-Arrhenius. Comme indiqué dans le journal PNAS , l'équipe IIS a modifié ce point de vue en considérant que l'eau se compose de deux états, appelé "rapide" et "lent, " qui sont structurellement différents, mais les deux obéissent à la dynamique d'Arrhenius.
"Nous avons simulé l'eau par la dynamique moléculaire et recherché des modèles structurels, " explique Rui Shi, co-auteur de l'étude. " Les molécules H2O s'assemblent toujours en tétraèdres, mais nous avons vu que certaines de ces structures locales étaient très ordonnées, d'autres moins." Les états désordonnés correspondent à l'eau rapide, et domine à haute température, tandis que l'état lent bien ordonné prend le relais lorsque l'échantillon se refroidit.
Surtout, les équations dérivées du modèle à deux états prédisent avec succès le croisement fragile à fort. Cela se produit bien au-dessus du point de transition vitreuse - le comportement vitreux semble être un faux-fuyant en ce qui concerne ce problème. Le fait que l'eau rapide a Arrhenius, plutôt que la loi de puissance, La dynamique résout également les prédictions erronées basées sur des tentatives antérieures de lier la fragilité de l'eau à certains aspects de son diagramme de phases.
"L'eau fragile peut être une illusion. La transition apparente est un artefact de l'équilibre dépendant de la température de deux états liquides forts, " dit l'auteur principal Hajime Tanaka. " La présence de deux états reflète la tendance de l'eau à former des structures locales, ce qui est plus facile à basse température. En réalité, autres liquides avec une transition fragile à forte, comme la silice, montrent également l'ordre local. Nous proposons que ceci, plutôt qu'un comportement vitreux, c'est ce qui les distingue des vrais liquides fragiles."