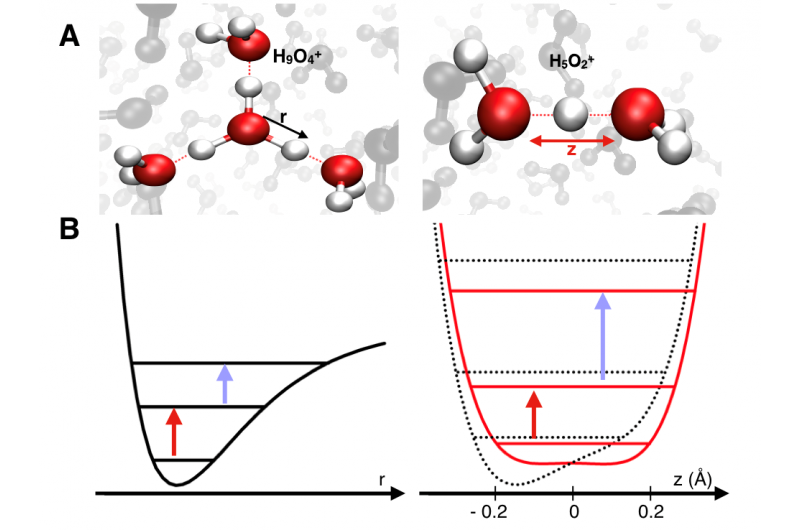
[A] Schéma du cation propre H9O4+ (à gauche) et du cation Zundel H5O2+ (à droite). Les flèches indiquent la coordonnée de liaison O-H r et la coordonnée de transfert de protons (O...H+...O) z. Dans le cation propre, une liaison covalente O-H localise le proton alors que dans le cation Zundel, le proton est délocalisé entre deux molécules d'eau. [B] Potentiel vibrationnel anharmonique (à gauche) et double potentiel minimum du cation Zundel le long de z (à droite, rouge). Les distorsions par le solvant environnant imposent une modulation du double potentiel minimum (à droite, ligne pointillée). Les flèches rouges et bleues indiquent les transitions entre les états quantiques particuliers du mouvement du proton, c'est à dire., la transition de l'état fondamental au premier état excité (rouge) et la transition du premier état excité au deuxième état excité (bleu). La modulation des potentiels conduit à des décalages spectraux des transitions vibrationnelles qui sont cartographiés par spectroscopie infrarouge bidimensionnelle. Crédit :MBI Berlin
Les processus de base en chimie et en biologie impliquent des protons dans un environnement aquatique. Les structures aquatiques abritant des protons et leurs mouvements sont jusqu'à présent restés insaisissables. Application de la spectroscopie vibrationnelle ultrarapide, les chercheurs ont cartographié les mouvements de transfert de protons fluctuants et ont fourni des preuves directes que les protons dans l'eau liquide sont principalement partagés par deux molécules d'eau. Les élongations femtosecondes des protons au sein d'un site d'hydratation sont 10 à 50 fois plus rapides que les sauts de protons vers un nouveau site, l'étape élémentaire de transfert de protons en chimie.
Le proton, le noyau H+ chargé positivement d'un atome d'hydrogène et la plus petite espèce chimique, est un acteur clé de la chimie et de la biologie. Les acides libèrent des protons dans un environnement d'eau liquide où ils sont très mobiles et dominent le transport de la charge électrique. En biologie, le gradient de concentration de protons à travers les membranes cellulaires est le mécanisme qui dirige la respiration et le stockage d'énergie des cellules. Même après des décennies de recherche, cependant, les géométries moléculaires dans lesquelles les protons sont logés dans l'eau et les étapes élémentaires de la dynamique des protons sont restées très controversées.
Les protons dans l'eau sont couramment décrits à l'aide de deux structures limites (Fig. 1A). Dans le complexe Eigen (H9O4+) (à gauche), le proton fait partie de l'ion central H3O+ entouré de trois molécules d'eau. Dans le cation Zundel (H5O2+) (à droite), le proton forme de fortes liaisons hydrogène avec deux molécules d'eau flanquantes. Une description au niveau moléculaire utilise la surface d'énergie potentielle du proton (Fig. 1B) qui est nettement différente pour les deux géométries limites. Comme le montre la figure 1B, on s'attend à un potentiel anharmonique simple minimum pour l'espèce Eigen et un potentiel double minimum pour l'espèce Zundel. Dans l'eau liquide, de tels potentiels sont de nature hautement dynamique et subissent des fluctuations très rapides dues aux mouvements thermiques des molécules d'eau environnantes et du proton.
Des chercheurs du Max Born Institute de Berlin, Allemagne, et l'Université Ben Gourion du Néguev à Beer-Sheva, Israël, ont maintenant élucidé les mouvements ultrarapides et les caractéristiques structurelles des protons dans l'eau dans des conditions ambiantes. Ils rapportent des résultats expérimentaux et théoriques en Science qui identifient le cation Zundel comme une espèce prédominante dans l'eau liquide. La femtoseconde (1 fs =10 -15 s) la dynamique des mouvements des protons a été cartographiée via des transitions vibrationnelles entre les états quantiques des protons (flèches rouges et bleues sur la figure 1B). La méthode sophistiquée de spectroscopie vibrationnelle bidimensionnelle fournit les contours jaune-rouge et bleu de la figure 2A qui marquent la plage d'énergie couverte par les deux transitions. Le contour bleu apparaît à des fréquences de détection plus élevées que le rouge, donnant la première preuve directe du caractère double-minimum du potentiel protonique dans l'environnement aqueux natif. En revanche, le contour bleu devrait apparaître à des fréquences de détection plus petites que le contour rouge.
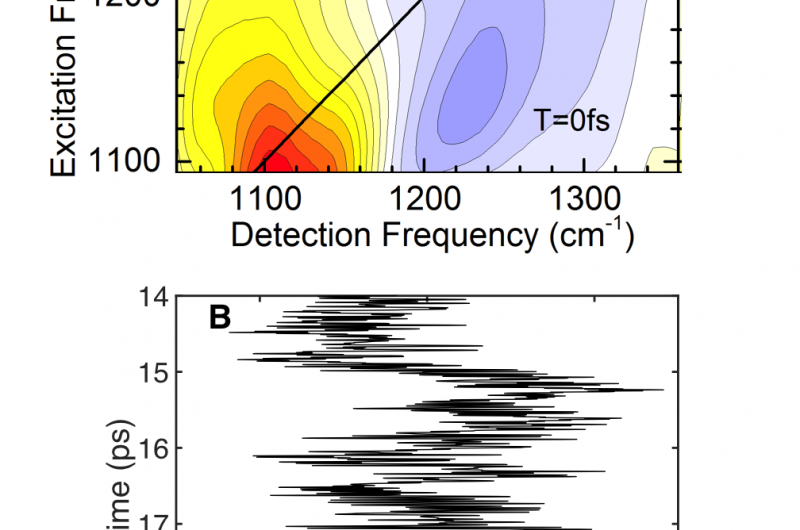
[A] Spectres vibrationnels bidimensionnels avec la transition de l'état fondamental au premier état excité (rouge) à une fréquence de détection inférieure à la transition du premier état excité au deuxième état excité (bleu). L'orientation des deux contours parallèlement à l'axe de fréquence d'excitation est due à des fluctuations de fréquence ultrarapides et à la perte de mémoire dans la position du proton. [B] Simulation de la dynamique en temps réel des mouvements des protons dans le cation Zundel. En moins de 100 fs, le proton présente des excursions de grande amplitude le long de z, la coordonnée reliant les deux molécules d'eau dans le cation Zundel. En raison de la modulation ultrarapide de la forme du potentiel protonique par les molécules de solvant environnantes, le proton explore tous les emplacements entre les deux molécules d'eau. Crédit :MBI Berlin
L'orientation des deux contours parallèlement à l'axe vertical des fréquences démontre que les deux transitions vibrationnelles explorent une vaste gamme de fréquences en moins de 100 fs, une caractéristique des modulations ultrarapides de la forme du potentiel protonique. En d'autres termes, le proton explore tous les emplacements entre les deux molécules d'eau en moins de 100 fs et perd très rapidement la mémoire de l'endroit où il se trouvait auparavant. La modulation du potentiel protonique est causée par le fort champ électrique imposé par les molécules d'eau dans l'environnement. Leur mouvement thermique rapide entraîne de fortes fluctuations de champ et, Donc, modulations d'énergie potentielle sur une échelle de temps inférieure à 100 fs. Cette image est étayée par des expériences de référence avec des cations Zundel préparés sélectivement dans un autre solvant et par des simulations théoriques détaillées de la dynamique du proton (Fig. 2B).
Un cation Zundel spécifique dans l'eau se transforme en de nouvelles géométries d'hébergement de protons par la rupture et la reformation des liaisons hydrogène. De tels processus sont beaucoup plus lents que le mouvement de tramage des protons et se produisent sur une échelle de temps de quelques picosecondes. Cette nouvelle image de la dynamique des protons est très pertinente pour le transport des protons par le mécanisme bien connu de von Grotthuss, et pour les mécanismes de translocation de protons dans les systèmes biologiques.