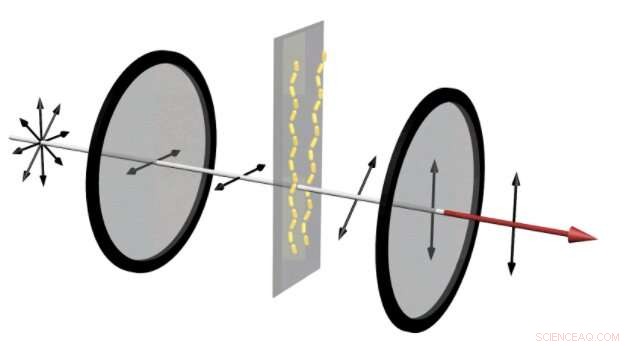
Dans un dispositif qui peut révéler si les protéines amyloïdes s'assemblent en chaînes, la lumière non polarisée pénètre dans un polariseur horizontal. Cela ne laisse passer que les ondes oscillant dans le sens horizontal. Puis, si les protéines amyloïdes ont assemblé les nanotiges d'or en chaînes, la lumière rouge se tord, changer l'angle de sa polarisation. Puis, lorsqu'il traverse le polariseur vertical, la partie de la lumière oscillant dans le sens vertical la traverse. Il en résulte un signal rouge fort visible à l'œil nu. Crédit :Jun Lu, Université de Jilin et Université du Michigan
Une nouvelle approche fabrique des balises de type cristal liquide à partir de protéines amyloïdes nocives présentes dans des maladies telles que le diabète de type II.
Dans une nouvelle technique de criblage de médicaments qui repose sur des nanotiges d'or pour tordre la lumière, une lueur rouge peut signaler l'échec d'un médicament conçu pour traiter les maladies « amyloïdes » telles que le diabète de type II et le cancer du pancréas.
La technique a été développée par des chercheurs de l'Université du Michigan, Université de Jilin en Chine, et l'Université fédérale de São Carlos au Brésil. Il exploite une propriété appelée « chiralité, " que l'on retrouve dans les nanostructures, des molécules biologiques comme des protéines, et des ondes lumineuses. Un objet chiral ne peut pas être superposé à son image miroir, comme une main gauche et une main droite, ou des hélices qui se tordent dans des directions différentes.
Les chercheurs ont pu profiter de la chiralité d'un marqueur protéique de ces maladies, appelés polypeptides amyloïdes des îlots. Ces protéines se lient en chaînes torsadées et s'accumulent dans les tissus. Les protéines amyloïdes qui forment des fibres en forme de tire-bouchon jouent également un rôle dans les maladies de Parkinson et de Huntington.
Dans la nouvelle approche, les nanotiges d'or sont recouvertes de protéines nocives, qui forment de longues fibres en forme de ressort avec trois nanotiges par tour. Ces structures apparaissent en rouge vif lorsqu'elles sont vues entre deux polariseurs à angles opposés, ou des filtres légers, parce que leur torsion, les formes chirales peuvent transformer la polarisation de la lumière.
"La forte torsion de la lumière permet de voir les résultats du dépistage des drogues à l'œil nu, au lieu d'utiliser des instruments compliqués, " dit Kun Liu, professeur de chimie à l'Université de Jilin et co-auteur d'un article récemment publié dans Science .

Dans l'appareil de gauche, les nanotiges d'or laissent passer une petite quantité de lumière à travers les deux polariseurs croisés. Cela s'apparente au signal montrant qu'un médicament conçu pour empêcher la formation de plaques amyloïdes fonctionne. Cependant, lorsque les protéines amyloïdes assemblent les nanotiges d'or en hélices, une lumière rouge claire est visible à travers les polariseurs, révélant qu'un médicament a échoué. Crédit :Jun Lu, Université de Jilin et Université du Michigan
Les nanotiges, chacune d'environ 50 nanomètres de long et 20 nanomètres de large, offrent des avantages supplémentaires.
"Les chaînes hélicoïdales périodiques augmentent la torsion de la lumière par 4, 600 fois, ce qui les rend visibles dans des conditions biologiques très difficiles. Et les nanotiges accélèrent également le processus de formation des chaînes amyloïdes, ce qui est essentiel pour la découverte rapide de médicaments, " a déclaré Nicolas Kotov, auteur co-correspondant de l'article et Irving Langmuir Distinguished University Professor of Chemical Sciences and Engineering à l'U-M.
Typiquement, les polypeptides amyloïdes mettent de quelques jours à une semaine pour se connecter. Cela ralentit les tests de médicaments potentiels. Les nanotiges accélèrent le processus des polypeptides amyloïdes à un jour. Cela se produit parce que les tiges sont recouvertes d'un agent chimique tensioactif appelé bromure de cétrimonium, similaire au chlorure de cétrimonium trouvé dans certains shampooings et revitalisants. Lorsque les protéines amyloïdes se lient au baril de la tige d'or, le tensioactif les aide à former une forme enroulée qui facilite la liaison à d'autres amyloïdes.
Lorsque les amyloïdes se connectent, leurs tiges d'or forment une hélice, se tordant autour de la corde de protéine. Et parce que l'or interagit fortement avec la lumière rouge, ces hélices très organisées tordent très fortement les ondes lumineuses rouges.
C'est ce qui permet de détecter facilement si un médicament destiné à prévenir les chaînes amyloïdes a fonctionné ou non. La configuration met le mélange réaliste de cellules, composants sanguins, molécules médicamenteuses et protéines amyloïdes que les médicaments rencontrent dans le corps entre deux polariseurs. Le premier polariseur ne laisse passer la lumière que s'il oscille dans le sens vertical. Le deuxième polariseur ne laisse passer que les ondes lumineuses se déplaçant dans la direction horizontale.
Si la lumière ne se tord pas entre les deux polariseurs, les deux polariseurs bloquent complètement la lumière. Voici ce qui se passe lorsqu'un médicament est efficace :aucune chaîne amyloïde ne se forme, donc seulement quelques nanotiges aléatoires font tourner la lumière. Très peu de lumière traverse les deux polariseurs. Cependant, si ces chaînes se forment, ils tordent la lumière rouge. Une lueur rouge devient clairement visible, ce qui montre que le médicament a échoué.
La vue à travers le polariseur montre où des structures de torsion de lumière se sont formées dans une soupe de cellules et de matériaux biologiques. Crédit :Jun Lu, Université de Jilin et Université du Michigan
"Alors que les expériences ont affiné les meilleures conditions pour détecter les chaînes amyloïdes, les simulations informatiques ont été fondamentales pour démêler les interactions complexes entre l'or, les tensioactifs et les fragments de protéines, qui doivent interagir simultanément pour faire fonctionner la plateforme, " dit André de Moura, professeur à l'Université fédérale de São Carlos et co-auteur de l'article.
L'équipe internationale a également établi des principes de conception unificateurs sur la façon de fabriquer des nanostructures torsadées qui peuvent considérablement tordre la lumière, une fonctionnalité essentielle pour de nombreuses applications.
L'œuvre représente un voyage de sept ans pour Jun Lu, maintenant chercheur en génie chimique à l'U-M. Au début de son doctorat. sous Liu en Chine, Lu a commencé par essayer d'amadouer les polypeptides amyloïdes des îlots humains pour qu'ils s'auto-assemblent, avec des tiges d'or attachées. Au bout d'un an environ, lui et Liu avaient trouvé des signes faibles que les assemblées tournaient la lumière. Suite à une rencontre fortuite à l'aéroport avec Kotov, l'équipe a commencé à travailler sur le mécanisme des interactions lumineuses et les utilisations pharmaceutiques de ces assemblages.
Lu a travaillé à rendre l'effet plus grand, dimensionner les nanotiges pour compléter la distance entre les nanotiges. L'équipe internationale a exploré l'application de dépistage de drogues, et Lu ont développé des simulations à l'aide du puissant superordinateur des Grands Lacs de l'Université du Michigan, tandis que son collaborateur de l'Université de São Paulo au Brésil, Kalil Bernardino, utilisé le supercalculateur SDumont pour confirmer les mécanismes derrière les mesures expérimentales.
Alors que le projet était long, Lu dit, "Chaque effort est bien récompensé. C'est comme un rêve devenu réalité."
L'article est intitulé "Amélioration de l'asymétrie optique dans les assemblages chiroplasmoniques supramoléculaires avec ordre à longue distance, " et sera publié en ligne par la revue Science jeudi, 25 février 2021.