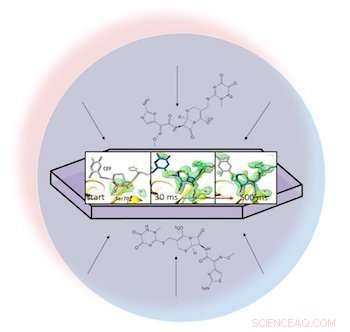
Dans une goutte de liquide (représentée par le cercle bleu clair), un antibiotique se disperse à travers une protéine cristallisée, bêta-lactamase, et s'y attache. Des instantanés aux rayons X de la paire liée ont permis aux chercheurs de créer des cartes de la densité électronique (vert) et de regarder un anneau dans l'antibiotique s'ouvrir (à l'extrême droite) 30 à 500 millisecondes après le début de la réaction. Crédit :Marius Schmidt/ Université du Wisconsin Milwaukee
Les scientifiques de l'Université Rice ont utilisé un laser à rayons X à impulsions rapides pour montrer comment les bactéries tuberculeuses résistantes aux médicaments désactivent les molécules antibiotiques destinées à traiter la maladie pulmonaire mortelle.
Le biochimiste du riz George Phillips et l'étudiant diplômé et co-auteur principal Jose Olmos font partie du centre BioXFEL soutenu par la National Science Foundation qui a capturé les résultats révolutionnaires de la preuve de principe grâce à une technique appelée cristallographie en série par mélange et injection.
Pour ce faire, il a fallu utiliser un nouvel outil, un laser à rayons X à électrons libres (XFEL) qui promet une sérieuse mise à niveau du minutieux, procédé centenaire de caractérisation des molécules par spectroscopie aux rayons X. Le laser est situé au SLAC National Accelerator Laboratory du Department of Energy de l'Université de Stanford.
La définition des structures moléculaires est essentielle pour comprendre leur fonctionnement, dit Phillips. La nouvelle découverte démontre la capacité en développement rapide des scientifiques à prendre des instantanés des processus biologiques dynamiques au fur et à mesure qu'ils se produisent.
Fidèle à son nom, la technique de mélange et d'injection alimente le laser en un flux étroit de molécules cristallisées dans une solution. Lorsque le laser frappe un cristal avec une impulsion de 20 femtosecondes (quadrillionième de seconde), il efface le cristal – mais pas avant de produire un motif de diffraction sur un détecteur qui montre la structure atomique de la molécule.
Dans un article en libre accès dans BMC Biology, les chercheurs dirigés par Marius Schmidt, professeur à l'Université du Wisconsin-Milwaukee, décrit le mélange de l'antibiotique ceftriaxone avec une enzyme résistante utilisée par les bactéries, bêta-lactamase, et l'alimenter au laser pulsé. Parce qu'ils pouvaient ajuster le temps entre le mélange et l'arrivée au laser, ils ont capturé des motifs de diffraction des molécules cristallisées non seulement dans des orientations aléatoires mais aussi à plusieurs stades d'interaction.
"Bien qu'il y ait eu des études élégantes pour observer les mouvements des protéines avec des changements induits par la lumière, notre travail montre qu'une classe plus large de protéines, à savoir les enzymes, peut être étudié en temps résolu au LCLS (Linac Coherent Light Source) et à d'autres XFEL, " dit Olmos.
Phillips a déclaré que l'expérience a prouvé l'utilité de XFEL pour capturer des motifs de diffraction à partir de cristaux d'un millionième de mètre de diamètre ou moins, beaucoup plus petit que les techniques précédentes. "Cela nous en apprendra davantage sur la façon dont la nature a sélectionné et conçu ces molécules pour qu'elles fonctionnent, ", a-t-il déclaré. "Ce n'est pas différent de voir un vélo pédaler :vous obtenez plus qu'une image statique et une meilleure compréhension de son fonctionnement.
"Chaque fois que vous voulez concevoir une protéine ou recréer une machine moléculaire, en savoir plus sur leur fonctionnement à un niveau fondamental va être utile, qu'il s'agisse de décomposer la cellulose pour les biocarburants, de concevoir un nouveau médicament ou d'améliorer un médicament existant. »
Dans ses présentations, Phillips compare la capacité de prendre des instantanés de protéines en action aux images du 19e siècle d'Eadweard Muybridge qui capturaient le mouvement à mi-course d'un cheval au galop. (Par coïncidence, le cheval appartenait au fondateur de Stanford.)
Les chercheurs s'attendent à ce que le XFEL bientôt mis à niveau à Stanford, une nouvelle installation en Europe et d'autres en cours dans le monde permettront aux scientifiques de capturer des structures en quelques minutes plutôt qu'en quelques jours et de leur fournir des données plus détaillées sur les processus chimiques.
Phillips a bon espoir que les outils améliorés aideront également à capturer les structures des molécules sans avoir à les cristalliser au préalable.
« Si nous pouvons obtenir le faisceau de rayons X et la diffusion de l'arrière-plan suffisamment petits et le faisceau de lecture suffisamment propre, puis en théorie, au lieu de parader des cristaux, nous pourrions faire défiler des molécules individuelles dans le laser pour créer des motifs de diffraction, " il a dit.
"Le laser de Stanford tire actuellement à 100 hertz (cycles par seconde), " a déclaré Phillips. " Le XFEL européen va tirer à 10, 000 hertz. C'est tout à fait une mise à niveau car cela nous donne beaucoup plus de chances de toucher les molécules lorsqu'elles affluent. »
Il a déclaré que le centre espère finalement capturer des données structurelles pour les réactions moléculaires à la volée.
"Ce pourrait être deux protéines qui se réunissent et apprennent à se reconnaître, il pourrait s'agir de l'interaction d'un virus avec un anticorps, ce pourrait être l'interaction d'un substrat avec une enzyme ou tout ce que vous pouvez faire en mélangeant ou avec une stimulation externe, " Phillips a dit. " Une fois que vous pouvez le faire, le ciel est la limite."