
Radiographie de la buse de travail, montrant le flux de protéines interne entouré par le jet d'éthanol. Crédit :Dominik Oberthuer, DESY
Les scientifiques s'intéressent à la structure spatiale des protéines pour en savoir plus sur le fonctionnement de ces biomolécules. Cette connaissance peut conduire à une meilleure compréhension des fonctions des biomolécules et à des médicaments adaptés. La cristallographie aux rayons X est le principal outil pour résoudre les structures des protéines. Cependant, il nécessite la croissance de cristaux des protéines étudiées. Lorsque les rayons X frappent ces cristaux, ils sont diffractés des atomes pour former un motif caractéristique à partir duquel la structure spatiale du cristal - et donc les molécules de protéines - peut être calculée.
Cependant, de nombreuses protéines n'aiment pas être comprimées en cristaux car cela contredit leur état naturel. "La croissance des cristaux de protéines est complexe. La quantité de protéines pouvant être produites est souvent limitée à quelques millionièmes de gramme, et souvent, seuls de très petits cristaux peuvent être obtenus, " dit Dominik Oberthür de DESY, auteur principal du rapport. Avec les flashs extrêmement brillants des lasers à rayons X à électrons libres, même ces microcristaux peuvent être analysés, mais généralement des milliers de modèles de diffraction sont nécessaires pour résoudre la structure de la protéine. Étant donné que les microcristaux délicats sont complètement vaporisés par le flash de rayons X intense après avoir délivré leur diagramme de diffraction, un flux de microcristaux frais est envoyé à travers le faisceau laser. Ce concept est connu sous le nom de cristallographie aux rayons X en série, et a permis l'analyse de nombreuses protéines auparavant inaccessibles.
Toujours, même ces microcristaux sont difficiles à obtenir, et seule une fraction est réellement touchée par le flash de rayons X, en fonction de la géométrie du flux cristallin et des paramètres techniques du laser à rayons X. "Moins de cristaux, le moins de matière protéique dont vous avez besoin, plus l'analyse est faisable, " dit Oberthür. L'équipe de Bajt a conçu un nouveau concept pour une buse de focalisation à double flux (DFFN) qui réduit considérablement la consommation de cristaux de protéines. Habituellement, les cristaux de protéines sont injectés avec un tampon liquide porteur dans le faisceau de rayons X à l'aide d'une buse spéciale. Pour former un jet fin, le liquide porteur est accéléré par un courant de gaz rapide entourant le liquide. Mais pour former un jet stable, un débit minimum est nécessaire, gaspillant généralement la plupart des cristaux dans le jet.

Concept de la nouvelle buse :un jet de gaz rapide (blanc) accélère un flux d'éthanol (bleu) dans lequel les cristaux de protéines porteurs de tampon (vert) sont injectés. Crédit :Anton Barty, DESY, et Juraj Knoška, Université de Hambourg
Pour surmonter ces difficultés, l'équipe a ajouté de l'éthanol comme liquide secondaire de « gaine » entre le gaz et le tampon. Cela conduit à l'accélération du liquide de gaine par le gaz. Les cristaux contenus dans leur tampon peuvent ensuite être injectés sous forme de flux très fin au centre du jet d'éthanol. "Avant, le tampon avec les cristaux devait faire deux tâches :former un jet stable et transporter des cristaux de protéines, " a expliqué Juraj Knoška, un doctorat étudiant au CFEL et à l'Université de Hambourg, qui a développé les buses. "Notre approche sépare ces rôles et utilise les liquides qui conviennent le mieux au travail." L'éthanol a des caractéristiques idéales pour former un jet très stable, qui s'écoule avec juste un fin jet de tampon de transport de cristal au centre. Par ici, le débit du tampon pourrait être réduit d'environ 40 microlitres (millionièmes de litre) à seulement deux microlitres par minute. Aussi, l'amende, Un flux stable de nanocristaux peut être maintenu en chevauchant précisément le petit faisceau du laser à rayons X. De plus, la réduction du débit global améliore la qualité des diagrammes de diffraction et la vitesse à laquelle les cristaux sont réellement touchés par les flashs de rayons X.
"Non seulement nous réduisons la consommation de cristal, mais notre buse de focalisation à double flux rend également l'utilisation de la source de rayons X plus efficace en augmentant la vitesse à laquelle nous collectons des motifs de diffraction de haute qualité, " dit Bajt. " De plus, l'utilisation du liquide de gaine nous permet d'étudier des protéines dans des tampons qui ne pouvaient pas être injectés auparavant. Notre concept élargit le spectre des biomolécules qui peuvent être analysées. » Son équipe a testé la nouvelle buse au laser à rayons X LCLS du SLAC National Accelerator Laboratory aux États-Unis. Les scientifiques ont fait équipe avec différents groupes pour résoudre les structures de diverses protéines .
"Avec le groupe du lauréat du prix Nobel Roger Kornberg de l'Université de Stanford, nous avons pu résoudre la structure de l'enzyme ARN polymérase II à température ambiante pour la première fois, " explique Oberthür. " Étant donné que la cristallographie à température ambiante est une condition préalable à l'étude détaillée de la dynamique structurelle, cela ouvre la porte à de futures études résolues dans le temps ou à des « films moléculaires » avec cet important système. » Le nouvel appareil a également été utilisé pour analyser deux autres enzymes, une hydrogénase liée à la membrane et une dioxygénase ainsi que des nanocristaux de protéines d'origine naturelle, du cocon protecteur d'un virus spécialisé (Cydia pomonella granulovirus, CpGV).
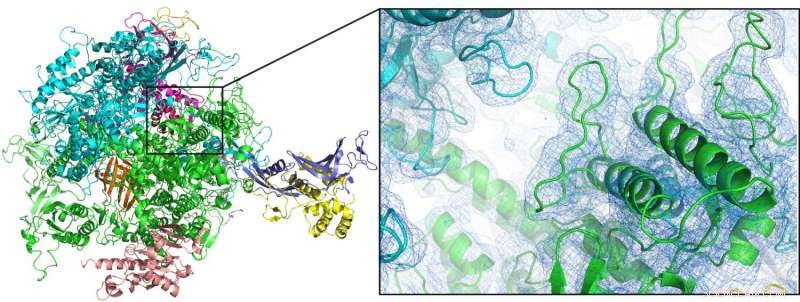
La première structure à température ambiante de l'enzyme ARN polymérase II (ici représentée sous forme de tracé de dessin animé) a pu être résolue par cristallographie femtoseconde en série à l'aide d'une buse à double flux focalisé. Crédit :Dave Bushnell, Université de Stanford, et Dominik Oberthür, DESY
La buse de focalisation à double flux élimine également un autre problème pratique de cette forme d'injection de jet :généralement, à la limite des buses classiques, matériau tampon, les cristaux de glace de protéines et d'eau s'agrègent au fil du temps pour former des caractéristiques semblables à des gouttes. La même chose se produit fréquemment au fond du réservoir de récupération sous la buse. Si ces stalactites et stalagmites de glace protéinée se développent dans le faisceau de rayons X, ils ne rendent pas seulement le motif de diffraction inutile, leurs réflexions peuvent être si fortes qu'elles détruisent le détecteur. Donc, de temps en temps, les expériences doivent être suspendues pour éliminer les gouttes de protéine-glace. "Le liquide de gaine dans notre buse empêche la formation de telles structures indésirables. La buse à double flux de focalisation a permis des conditions expérimentales stables pendant de nombreuses heures, " explique Oberthür.
"Dans toutes les expériences, la buse a extrêmement bien fonctionné, " résume Bajt. " On pourrait réduire le nombre d'interruptions de dix à zéro dans une équipe, et nous nous attendons à ce que les stations expérimentales d'autres lasers à rayons X et de sources de lumière synchrotron comme le PETRA III de DESY puissent également bénéficier des avantages de notre appareil."