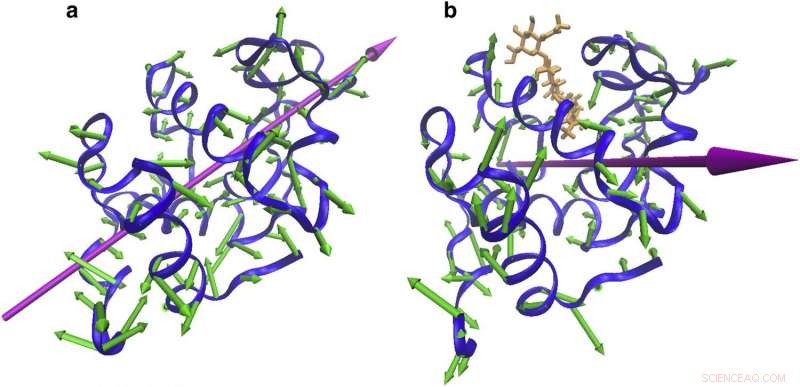
Changements de direction vibratoire avec grippage. Vibrations protéiques indiquant (a) un mouvement de serrage autour du site de liaison à 55 cm-1 de NMA de CEWL libre et (b) une torsion autour du site de liaison. Crédit :Réimprimé avec la permission de Biophysical Journal.
A chaque instant à l'intérieur du corps humain, une danse soigneusement chorégraphiée est exécutée.
Les protéines secouent leur corps et agitent leurs membres, le tout dans le but d'optimiser leur interaction avec d'autres molécules, y compris d'autres protéines. Ces petits mouvements, appelés vibrations, permettre aux molécules de changer de forme rapidement pour se lier les unes aux autres, ce qui à son tour facilite des tâches telles que l'absorption d'oxygène et la réparation des cellules.
L'efficacité du corps à remplir ces fonctions dépend de la façon dont les protéines peuvent interagir.
Mais qu'est-ce qui fait qu'une protéine est meilleure prétendante qu'une autre ?
Une nouvelle étude éclaire cette question, montrant que dans cette parade nuptiale biologique, les mouvements de danse comptent.
"Autrefois, la recherche sur les vibrations des protéines s'est beaucoup concentrée sur l'énergie de ces vibrations, " déclare Andrea Markelz, scientifique principale, Doctorat, professeur de physique à l'Université du Buffalo College of Arts and Sciences. "Mais ce que nous avons découvert, c'est que la direction du mouvement semble avoir plus d'importance. La direction du mouvement - la direction dans laquelle les différentes parties de la protéine se déplacent - peut vraiment déterminer dans quelle mesure une protéine remplit sa fonction biologique."
Les résultats aident à jeter les bases du développement de médicaments ciblant les vibrations moléculaires. De tels produits pharmaceutiques empêcheraient les protéines d'effectuer des tâches qui contribuent à la maladie.
"Nous avons mené la recherche en utilisant une nouvelle technique que nous avons développée appelée microscopie térahertz anisotrope (ATM), qui révèle comment la nature exploite les mouvements des protéines pour améliorer l'efficacité. Nous pouvons alors optimiser ces mouvements pour la médecine et la biotechnologie, " dit la première auteure Katherine Niessen, un doctorant de l'UB en physique.
La recherche, publié le 14 mars dans Journal biophysique , a été menée par UB, l'Université de Pérouse en Italie, et l'Institut de recherche médicale Hauptman-Woodward. Il a été financé par la National Science Foundation (NSF).
Fox-trot ou tango ?
L'étude s'est concentrée sur le lysozyme de blanc d'œuf de poule, une protéine présente dans les blancs d'œufs.
Comme première étape de leur projet, les scientifiques ont comparé les vibrations régulières du lysozyme aux vibrations du lysozyme lorsqu'il était lié à une molécule dont la présence empêchait la protéine de remplir ses fonctions biologiques habituelles.
Ce que les scientifiques ont vu, c'est que les lysozymes libres et inhibés vibraient à des énergies similaires, mais avec des directions de mouvement distinctes :le lysozyme libre voltigeait avec une action de battement semblable à une charnière - comme les ailes d'un papillon - tandis que le lysozyme inhibé se déplaçait dans un modèle plus semblable à des ciseaux.
"Le résultat a été un changement fondamental par rapport à la vision conventionnelle. Les vibrations ont changé de direction, même si l'énergie des mouvements est restée la même, " dit Markelz. (Elle ajoute que par analogie, cela s'apparente à deux personnes exécutant des danses différentes - le fox-trot et le tango, par exemple, mais en exerçant la même quantité d'énergie.)
La même dynamique est apparue lorsque l'équipe a comparé le lysozyme ordinaire à un lysozyme de blanc d'œuf de poule mutant qui était plus efficace pour accomplir son travail. Les lysozymes mutants et normaux avaient les mêmes énergies vibratoires, mais des directions vibratoires différentes.
Un instrument clé en main pour mesurer les vibrations
La recherche sur les vibrations moléculaires pourrait ouvrir de nouvelles voies pour le développement de médicaments et la récupération d'énergie artificielle (les vibrations peuvent expliquer pourquoi la photosynthèse est si efficace). Mais historiquement, les minuscules impulsions et palpitations au sein des protéines ont été très difficiles à étudier.
Markelz espère changer cela en développant un instrument clé en main que les scientifiques du monde entier peuvent utiliser pour rechercher les vibrations.
Pour étudier le lysozyme de blanc d'œuf de poule, son équipe a utilisé la technique ATM que son groupe de recherche a développée en interne. Contrairement aux autres méthodes utilisées pour rechercher les vibrations des protéines, L'ATM permet aux scientifiques d'observer non seulement les énergies vibratoires, mais aussi la direction des mouvements.
La NSF a récemment décerné à Markelz près de 400 $, 000 000 pour commercialiser un instrument ATM facile à utiliser, ce qui augmenterait la capacité de la communauté scientifique à explorer les vibrations moléculaires. L'appareil représenterait une grande avancée par rapport aux autres méthodes existantes, qui ne donnent qu'un aperçu grossier des vibrations et nécessitent des environnements extrêmement secs et froids et des installations coûteuses, dit Markelz.