En 1869, Dmitri Mendeleev a publié un article intitulé "Sur la relation entre les propriétés des éléments et leur poids atomique". Dans cet article, il a produit un arrangement ordonné des éléments, en les énumérant par ordre croissant de poids et en les organisant en groupes basés sur des propriétés chimiques similaires. Bien que de nombreuses décennies se soient écoulées avant que les détails de la structure atomique ne soient découverts, la table de Mendeleev a déjà organisé les éléments en fonction de leur valence.
Éléments et poids atomique
À l'époque de Mendeleev, les atomes étaient considérés comme des entités uniques et indivisibles . Certains étaient plus lourds que d'autres, et il semblait raisonnable d'ordonner les éléments en augmentant le poids. Il y a deux problèmes avec cette approche. Premièrement, mesurer le poids est une tâche délicate, et bon nombre des poids acceptés de l'époque de Mendeleev n'étaient pas corrects. Deuxièmement, il s'avère que le poids atomique n'est pas vraiment le paramètre pertinent. Les tableaux périodiques d'aujourd'hui placent les éléments dans l'ordre de leur numéro atomique, qui est le nombre de protons dans le noyau. À l'époque de Mendeleev, les protons n'avaient pas encore été découverts.
Éléments et propriétés chimiques
Mendeleev a écrit que "l'arrangement en fonction du poids atomique correspond à la valence de l'élément et dans une certaine mesure à la différence de comportement chimique. . " La valence, dans la compréhension de Mendeleev, était une indication de la capacité d'un élément à se combiner avec d'autres éléments. Mendeleev a combiné l'ordre du poids atomique avec des valences communes pour organiser les éléments dans un tableau. Autrement dit, il a organisé les éléments en groupes en fonction de leurs caractéristiques chimiques. Étant donné que ces propriétés se répètent de temps en temps, le résultat est un tableau périodique dans lequel chaque colonne verticale, appelée groupe, contient des éléments ayant des caractéristiques similaires, et chaque ligne horizontale, appelée période, organise les éléments en fonction de leur poids, en augmentant de gauche à droite. et de haut en bas.
Structure atomique
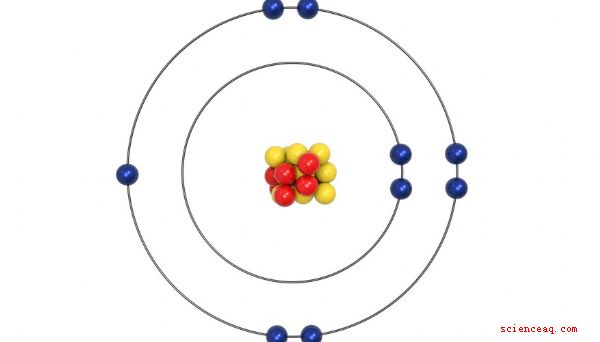
Environ 50 ans après le premier tableau périodique de Mendeleev, les scientifiques ont découvert que l'atome était construit autour d'un noyau avec des protons chargés positivement et des neutrons neutres - tous deux relativement lourds. Le noyau chargé positivement est entouré d'un nuage d'électrons chargés négativement. Le nombre de protons - également appelé numéro atomique - correspond généralement au nombre d'électrons. Il s'avère que le nombre d'électrons qu'un élément possède détermine en grande partie ses propriétés chimiques. Ainsi, l'ordre approprié dans le tableau périodique est déterminé par le nombre d'électrons, et non par le poids comme Mendeleev l'avait proposé à l'origine.
Valence Electrons
Les électrons dans le nuage entourant le noyau d'un élément sont disposés en couches, appelées coquilles . Chaque coquille a un nombre spécifique d'électrons qu'elle peut contenir. Lorsque chaque coquille est remplie, une nouvelle coquille est ajoutée jusqu'à ce que tous les électrons soient pris en compte. Les électrons dans la coquille la plus externe sont appelés électrons de valence, car ce sont leurs interactions qui déterminent les propriétés chimiques d'un élément. Les colonnes qui ont été configurées pour regrouper les éléments par des propriétés chimiques similaires se révèlent être exactement les mêmes colonnes définies par le nombre d'électrons de valence. Les éléments du groupe 1A n'ont qu'un seul électron de valence, et chaque colonne du groupe A à droite ajoute un électron de valence supplémentaire. L'organisation devient un peu trouble avec les éléments du groupe B, mais chacun d'eux est également groupé par leur nombre d'électrons de valence.