Rapport de chercheurs de l'Université de Kanazawa dans le Journal of Physical Chemistry Letters des études de microscopie à force atomique à grande vitesse qui mettent en lumière le rôle possible de la protéine du cadre de lecture ouvert 6 (ORF6) dans les symptômes du COVID-19.
Alors que de nombreux pays à travers le monde connaissent un répit face à la propagation intense des infections par le SRAS-CoV-2 qui a conduit à des niveaux tragiques de maladie et à de multiples confinements nationaux au début de la décennie, les cas d'infection persistent.
Une meilleure compréhension des mécanismes qui maintiennent le virus dans l’organisme pourrait aider à trouver des traitements plus efficaces contre les maladies causées par la maladie, ainsi qu’à se prémunir contre de futures épidémies d’infections similaires. Dans cette optique, les protéines accessoires produites par le virus pour l’aider à se développer dans l’organisme ont suscité beaucoup d’intérêt.
"Semblable à d'autres virus, le SRAS-CoV-2 exprime un ensemble de protéines accessoires pour reprogrammer l'environnement hôte afin de favoriser sa réplication et sa survie", expliquent Richard Wong de l'Université de Kanazawa et Noritaka Nishida de l'Université de Chiba et leurs collègues dans cette dernière étude. rapport. Parmi ces protéines accessoires se trouve ORF6.
Des études antérieures ont proposé qu'ORF6 interfère avec le fonctionnement de l'interféron 1 (IFN-I), un type particulier de petite protéine utilisée dans le système immunitaire, ce qui peut expliquer les cas d'infection asymptomatique par le SRAS-CoV2. Il existe également des preuves selon lesquelles ORF6 provoque la rétention de certaines protéines dans le cytoplasme tout en perturbant le transport de l'ARNm depuis la cellule, ce qui pourrait constituer un moyen d'inhiber la signalisation de l'IFN-I. Cependant, le mécanisme de cette rétention des protéines et de cette perturbation du transport n'était pas clair.
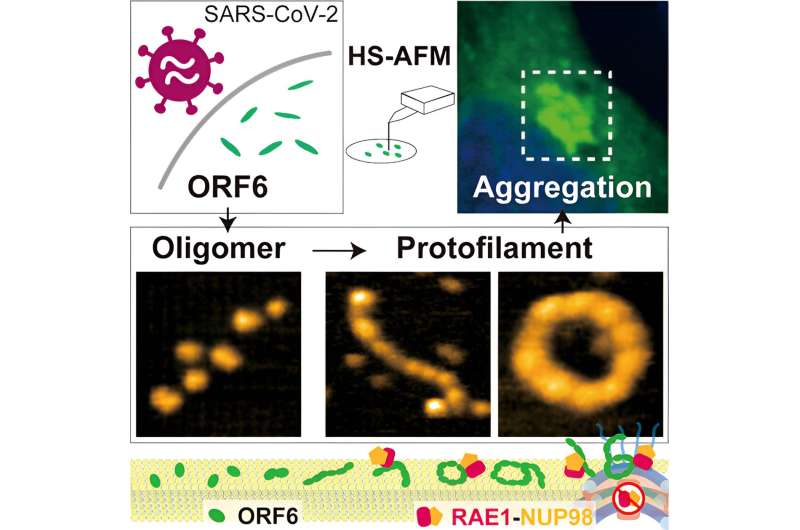
Pour faire la lumière sur ces mécanismes, les chercheurs ont d’abord étudié les indices que différents logiciels pourraient donner sur la structure d’ORF6. Ceux-ci indiquaient la présence probable de plusieurs régions intrinsèquement désordonnées. Les mesures de résonance magnétique nucléaire ont également confirmé la présence d'un segment désordonné très flexible.
Bien que l'algorithme d'apprentissage automatique AlphaFold2 se soit révélé très utile pour déterminer comment les protéines se replient, la présence de ces régions intrinsèquement désordonnées limite son utilisation pour établir la structure de l'ORF6. Les chercheurs ont donc utilisé la microscopie à force atomique à grande vitesse (HS-AFM), qui est capable d'identifier des structures en détectant la topographie des échantillons de la même manière que l'aiguille d'un tourne-disque traverse les rainures d'un vinyle.
En utilisant HS-AFM, les chercheurs ont établi que l'ORF 6 se présente principalement sous la forme de filaments ellipsoïdaux d'oligomères, des chaînes d'unités moléculaires répétitives mais plus courtes que les polymères. La longueur et la circonférence de ces filaments étaient maximales à 37°C et minimales à 4°C, de sorte que la présence de fièvre pourrait être bénéfique pour produire des filaments plus gros. Les substrats constitués de lipides (composés gras) encouragent également la formation d'oligomères plus gros.
Étant donné que HS-AFM capture les images si rapidement, il a été possible de saisir non seulement les structures, mais également certaines dynamiques du comportement de l'ORF6, notamment le mouvement circulaire, l'assemblage et le retournement des protéines. En outre, une analyse informatique plus approfondie a également révélé que les filaments avaient tendance à s’agréger en amyloïdes, comme on le trouve dans certaines maladies neurodégénératives, et que cela peut entraîner des complications dans les symptômes du COVID-19. Comme le soulignent les chercheurs, cette agrégation « séquestre efficacement un grand nombre de protéines hôtes, en particulier les facteurs de transcription impliqués dans la signalisation de l'IFN-I ».
Puisque ces filaments se brisent en présence de certains alcools, d'urée ou de dodécylsulfate de sodium Wong, Nishida et leurs collègues concluent que la protéine est en grande partie maintenue ensemble par des interactions hydrophobes. "Les candidats médicamenteux potentiels qui dissocient les agrégats ORF6 en perturbant les interactions hydrophobes devraient être considérés et testés dans un avenir proche pour évaluer leur valeur thérapeutique dans la gestion et le traitement du COVID-19", déclarent les chercheurs.
Plus d'informations : Goro Nishide et al, Élucidation nanoscopique de l'auto-assemblage spontané de la protéine du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) Open Reading Frame 6 (ORF6), The Journal of Physical Chemistry Letters (2023). DOI :10.1021/acs.jpclett.3c01440
Informations sur le journal : Journal des lettres de chimie physique
Fourni par l'Université de Kanazawa