Dans la nature, les molécules organiques sont soit gauchères, soit droites, mais il est difficile de synthétiser des molécules avec une « manibilité » spécifique en laboratoire. Fabriquez un médicament ou une enzyme avec une mauvaise « doigté » et cela ne fonctionnera tout simplement pas. Aujourd'hui, les chimistes de l'Université de Californie à Davis se rapprochent de l'imitation de l'efficacité chimique de la nature grâce à la modélisation informatique et à l'expérimentation physique.
Dans une étude parue le 10 janvier dans Nature , le professeur Dean Tantillo, les étudiants diplômés William DeSnoo et Croix Laconsay et leurs collègues de l'Institut Max Planck en Allemagne rapportent la synthèse réussie de molécules chirales spécifiques ("à main") utilisant des réarrangements d'hydrocarbures simples en présence de catalyseurs organiques complexes. La plupart des composés biologiques, y compris de nombreux médicaments sur ordonnance, sont chiraux.
Tantillo et ses collègues espèrent que les résultats permettront aux scientifiques de mieux exploiter les hydrocarbures à diverses fins, telles que les précurseurs de médicaments et de matériaux.
"La nouveauté de cet article est que c'est vraiment la première fois, à ma connaissance, que quelqu'un parvient à obtenir un déplacement de carbocation qui produit l'un des produits à image miroir plutôt que l'autre avec une sélectivité élevée", a déclaré Tantillo. /P>
En chimie, la chiralité est une propriété qui fait référence à une paire de molécules qui partagent une composition atomique mais sont des images miroir l'une de l'autre. Comme vos mains gauche et droite, elles ne peuvent pas se superposer.
"Les chimistes de synthèse veulent souvent fabriquer des molécules qui se présentent sous la forme d'une image miroir, mais ils n'en veulent qu'une seule", a déclaré Tantillo. "Par exemple, si vous souhaitez fabriquer une molécule médicamenteuse, vous avez souvent besoin de l'une des deux formes chirales pour se lier sélectivement à une cible protéique ou enzymatique."
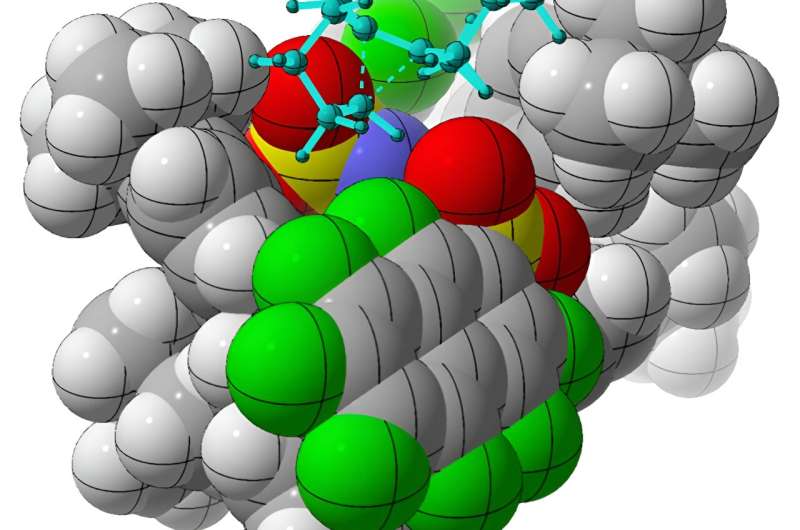
Y parvenir peut être difficile en laboratoire car ces molécules, selon Tantillo, sont souvent comme "de petites boules de graisse avec une charge positive étalée autour d'elles".
La nature grasse de ces molécules rend généralement difficile la liaison d'un catalyseur chimique dans une orientation plutôt qu'une autre en raison du manque de groupes chargés sur lesquels le catalyseur peut s'accrocher.
Mais les chercheurs ont trouvé une solution. En utilisant un acide organique chiral, l’imidodiphosphorimidate, comme catalyseur, l’équipe a réussi à réaliser des réarrangements d’alcénylcycloalcanes achiraux, produisant des molécules chirales d’intérêt appelées cycloalcènes. À l'aide de méthodes informatiques, Tantillo et ses collègues ont déduit comment le catalyseur produit sélectivement une forme chirale plutôt qu'une autre.
Tantillo a déclaré que la réaction qui en résulte est similaire au comportement dans la nature des enzymes qui fabriquent des produits hydrocarbonés appelés terpènes. Une partie des recherches de Tantillo concerne la cartographie des voies de réaction des terpènes à l'aide de méthodes de mécanique quantique.
"S'il existe plusieurs voies possibles vers un produit, alors chaque fois que vous vous arrêtez à un intermédiaire sur cette voie, vous avez la possibilité d'obtenir des sous-produits provenant de cet intermédiaire", a-t-il déclaré. "Il est donc important de savoir quand et pourquoi un carbocation veut s'arrêter en route vers un terpène donné si l'on veut comprendre et finalement repenser les enzymes formant des terpènes."
La nouvelle méthode pourrait en principe être exploitée pour produire à la fois des molécules naturelles et des molécules non naturelles.
"Il est difficile de dire si ces choses seront un jour faites, mais le pétrole est une source de beaucoup d'hydrocarbures, et si vous pouviez les transformer de manière catalytique en molécules avec une chiralité définie, vous auriez augmenté la valeur de ces molécules", a déclaré Tantillo. .
Les autres co-auteurs sont :Vijay Wakchaure, Markus Leutzsch et Benjamin List, Max Planck Institut für Kohlenforschung, Mülheim an der Ruhr, Allemagne ; et Nobuya Tsuji, Université d'Hokkaido, Sapporo, Japon.
Plus d'informations : Vijay N. Wakchaure et al, Déplacements cationiques asymétriques catalytiques des hydrocarbures aliphatiques, Nature (2024). DOI :10.1038/s41586-023-06826-7
Informations sur le journal : Nature
Fourni par UC Davis