Des chercheurs de l'Université de Californie à Irvine ont découvert de profondes similitudes et des différences surprenantes entre les humains et les insectes dans la production de la molécule critique absorbant la lumière de la rétine, le 11-cis-rétinal, également connu sous le nom de « chromophore visuel ». Les résultats approfondissent la compréhension de la façon dont les mutations de l'enzyme RPE65 provoquent des maladies de la rétine, en particulier l'amaurose congénitale de Leber, une maladie cécitante dévastatrice chez l'enfant.
Pour l'étude, récemment publiée dans la revue Nature Chemical Biology , l'équipe a utilisé la cristallographie aux rayons X pour étudier NinaB, une protéine présente chez les insectes qui fonctionne de manière similaire à la protéine RPE65 présente chez l'homme. Les deux sont cruciaux pour la synthèse du 11-cis-rétinien et leur absence entraîne une grave déficience visuelle.
"Notre étude remet en question les hypothèses traditionnelles sur les similitudes et les différences entre la vision humaine et celle des insectes", a déclaré l'auteur correspondant Philip Kiser, professeur agrégé UCI de physiologie et de biophysique ainsi que d'ophtalmologie. "Bien que ces enzymes partagent une origine évolutive commune et une architecture tridimensionnelle, nous avons constaté que le processus par lequel elles produisent le 11-cis-rétinal est distinct."
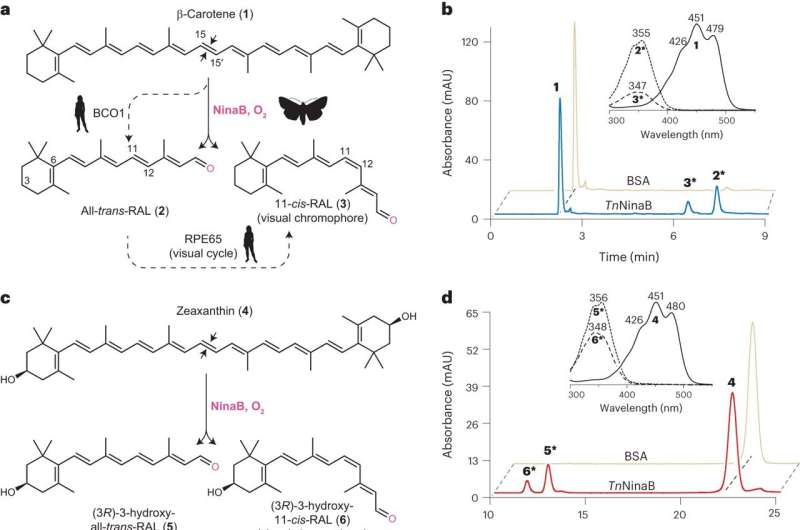
La création du 11-cis-rétinien commence par la consommation d'aliments comme les carottes ou les citrouilles contenant des composés utilisés pour la génération de vitamine A, comme le bêta-carotène. Ces nutriments sont métabolisés par les enzymes de clivage des caroténoïdes, notamment NinaB et RPE65.
On savait auparavant que les humains avaient besoin de deux de ces enzymes pour produire du 11-cis-rétinal à partir du bêta-carotène, alors que les insectes pouvaient réaliser cette conversion avec seulement du NinaB. Comprendre comment NinaB peut coupler les deux étapes en une seule réaction ainsi que les relations fonctionnelles entre NinaB et RPE65 était une motivation clé pour l'étude.
"Nous avons constaté que structurellement, ces enzymes sont très semblables, mais les endroits dans lesquels elles exercent leur activité sont différents", a déclaré l'auteur principal Yasmeen Solano, étudiante diplômée du laboratoire de Kiser au Centre UCI pour la recherche translationnelle sur la vision.
"La compréhension des caractéristiques clés de la structure de NinaB a conduit à une meilleure compréhension de la machinerie catalytique nécessaire pour soutenir la fonction des pigments visuels rétiniens. Grâce à notre étude de NinaB, nous avons pu en apprendre davantage sur la structure d'une partie clé de RPE65 qui n'avait pas été résolu auparavant. Cette découverte est essentielle pour comprendre et traiter les mutations avec perte de fonction dans RPE65. "
Parmi les autres membres de l'équipe figuraient Michael Everett, un jeune spécialiste du laboratoire Kiser, ainsi que Kelly Dang et Jude Abueg, alors étudiants en sciences biologiques.
Plus d'informations : Yasmeen J. Solano et al, Les enzymes de clivage des caroténoïdes ont évolué de manière convergente pour générer le chromophore visuel, Nature Chemical Biology (2024). DOI :10.1038/s41589-024-01554-z
Fourni par l'Université de Californie, Irvine