De la maladie de Parkinson à la maladie d'Alzheimer en passant par l'arythmie cardiaque, les amyloïdes sont liées à un certain nombre de maladies. Ces agrégats de protéines se forment dans l’organisme lorsqu’une protéine perd sa structure normale et se replie mal ou mute. Et comme bon nombre de ces protéines sont volumineuses et complexes, la manière dont certaines de ces mutations se produisent et s'agrègent reste un mystère, tout comme la création de traitements efficaces.
De nouvelles recherches sur le glaucome menées par des chimistes de Georgia Tech et une ancienne élève pourraient contribuer à changer cela.
"De nombreux travaux ont été réalisés pour comprendre comment des protéines repliées plus petites forment des agrégats amyloïdes, mais cette étude nous aide à comprendre la voie d'agrégation d'un système plus grand et plus complexe", explique la co-première auteure Emily Saccuzzo. Ce travail pourrait un jour aider les scientifiques à découvrir de nouveaux modes de traitement, non seulement pour le glaucome, mais également pour d'autres maladies causées par l'agrégation des protéines.
Saccuzzo a lancé le projet en 2018 en tant qu'étudiant diplômé au laboratoire Lieberman de l'école de chimie et de biochimie de Georgia Tech, et est maintenant associé de recherche postdoctoral aux laboratoires nationaux du nord-ouest du Pacifique.
"Emily était étudiante d'été avant de s'inscrire et elle a établi la faisabilité initiale de ces expériences", explique Raquel Lieberman, professeur et titulaire de la chaire Sepcic Pfeil en chimie à Georgia Tech. "Je suis immensément fier d'elle."
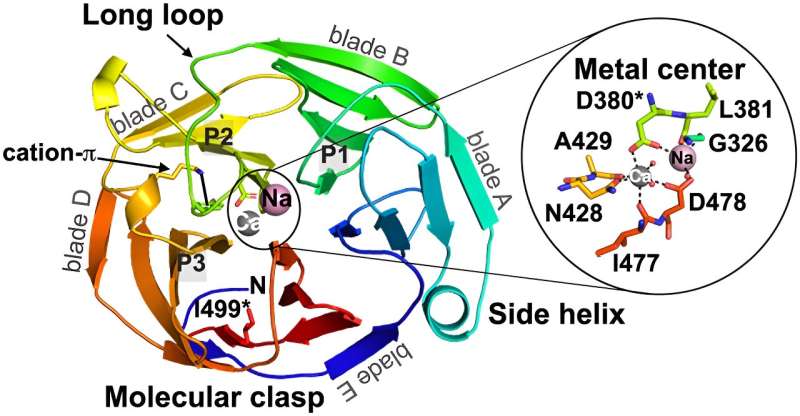
Les découvertes récentes de leur équipe de recherche sont présentées dans un article intitulé "Compétition entre le déroulement intérieur et l'agrégation pathogène dans une hélice β formant de l'amyloïde", publié dans la revue Nature Communications. .
Lieberman et Saccuzzo ont réuni des chercheurs de tout l'Institut et d'au-delà pour collaborer à l'étude.
"Il s'agissait d'un projet très multidisciplinaire et c'est toujours très satisfaisant", déclare Lieberman. "Je pense que lorsque vous rassemblez plus de personnes autour de la table, vous pouvez répondre à des questions difficiles et faire plus que ce que vous pouvez faire seul."
Alors que de nombreuses études se sont concentrées sur des protéines plus petites, appelées protéines modèles, qui ont établi des « règles » et des modèles connus pour la formation d'amyloïde (un type spécialisé d'agrégation de protéines), la protéine qui contribue au glaucome est plus grande et plus complexe. Ce type de protéine plus grosse et complexe est relativement peu étudié.
"Nous savions depuis un certain temps que des mutations dans la myociline peuvent provoquer un mauvais repliement et une agrégation de la protéine, ce qui conduit à son tour au glaucome", explique Saccuzzo. "Ce que nous ne savions pas, cependant, c'était le mécanisme exact par lequel cette protéine se replie mal et s'agrège.
"Le but de cette étude était de déterminer comment les mutants de la maladie se replient mal, dans l'espoir que cela nous donnerait un aperçu des premières étapes du processus d'agrégation", ajoute-t-elle.
Située à l'interface entre le blanc de l'œil et l'iris coloré, la protéine forme un tout petit anneau tout autour de l'œil.
"Chaque fois que vous clignez des yeux, vous étirez ce muscle. Chaque fois que le vent souffle très fort ou que vous avez quelque chose dans les yeux. Chaque fois que vous vous frottez les yeux, vous pourriez affecter cette protéine, même si elle ne provoque pas de maladie", a déclaré Lieberman. dit.
Pourtant, les scientifiques ne sont pas sûrs de l’action de cette protéine. "Nous ne savons ce que cela fait que lorsque cela cause des problèmes", comme le glaucome, explique-t-elle. "Nous ne savons pas quelle est sa véritable fonction biologique."
Lieberman a été initialement attirée par l'idée d'étudier la protéine parce qu'elle se demandait si les recherches effectuées sur les protéines modèles pourraient être applicables à la protéine responsable du glaucome.
"Les toutes premières études ont montré qu'elle était probablement similaire à ces protéines modèles qui forment l'amyloïde", explique Lieberman. "Je voulais me pencher sur cela parce que si nous pouvions montrer que c'était vrai, nous pourrions alors exploiter les ressources incroyables et les recherches effectuées sur des systèmes modèles pour nous aider à combattre la maladie."
"Il s'agissait de l'une des plus grandes protéines formant de l'amyloïde caractérisées à ce jour", explique Saccuzzo, et même si l'équipe espérait trouver des similitudes avec les protéines modèles, la plus grande protéine associée au glaucome a montré une complexité accrue.
"Je pense que l'une des observations les plus surprenantes que nous ayons faites est que la protéine elle-même n'est pas à l'équilibre pendant environ 90 jours après sa production", ajoute Lieberman. "L'un des principes de la chimie des protéines est que les séquences d'acides aminés adoptent une structure unique et que toutes les informations nécessaires pour intégrer la protéine dans sa structure 3D sont contenues dans cette séquence d'acides aminés."
Ici, la protéine vacillait en petite quantité, ce qui signifiait qu'elle n'était pas à l'équilibre. "Il se passe bien plus de choses dans le système que ce que l'on aurait pu imaginer", explique Lieberman. "Nous supposons que la forme contrôle certaines propriétés, mais c'est un autre mystère de cette protéine."
Parce que la protéine est si complexe et n'est pas à l'équilibre, "il existe une longue liste de choses que nous ne pouvons pas prédire", explique Lieberman, ajoutant que cela rend les prédictions informatiques difficiles, ainsi que certaines expériences. "C'est à ce moment-là que nous avons pensé :wow, voici ce nouveau système auquel les gens devraient réfléchir. Les règles pourraient être affinées pour nous aider à mieux comprendre ce qui se passe."
Même si des recherches supplémentaires devront être menées afin de déterminer la meilleure façon de traiter le glaucome, l'étude constitue une base essentielle pour les études futures. "Ce qui ne m'est pas clair pour le moment, c'est si nous serions capables de trouver un médicament pour toutes les personnes porteuses de mutations, ou si nous avions besoin d'un médicament spécifique pour chaque type de mutation que nous rencontrerions", explique Lieberman. P>
Même si la recherche ne prouve pas qu'un traitement pourrait ne pas être efficace pour tous, "elle montre certainement que ce système offre bien plus que ce à quoi nous nous attendions."
"Comprendre à quoi ressemblent les mutants de la maladie au niveau moléculaire pourrait aider à ouvrir la voie à des thérapies et à des outils de diagnostic du glaucome structurellement spécifiques", ajoute Saccuzzo.
Lieberman et Saccuzzo soulignent également que les travaux effectués pour comprendre la protéine responsable du glaucome peuvent également être appliqués à d'autres grosses protéines.
"En fin de compte, il y a plus de protéines qui ne sont pas des protéines modèles que de protéines modèles", explique Lieberman.
"Il existe beaucoup plus de systèmes, et je soupçonne qu'il existe beaucoup plus de protéines qui peuvent s'agréger et contribuer à la maladie ou au vieillissement qui n'ont pas encore été explorées. Je pense que cette recherche montre l'intérêt d'apporter de nombreuses approches différentes pour sonder un système compliqué pour en savoir plus."
Plus d'informations : Emily G. Saccuzzo et al, Compétition entre le déploiement inversé et l'agrégation pathogène dans une hélice β formant de l'amyloïde, Nature Communications (2024). DOI :10.1038/s41467-023-44479-2
Informations sur le journal : Communications naturelles
Fourni par l'Institut de technologie de Géorgie