Comprendre les mécanismes moléculaires qui sous-tendent le phénomène de photosynthèse peut permettre des progrès significatifs dans les domaines de la biotechnologie et des énergies renouvelables. Le photosystème II (PSII), un complexe protéique, joue un rôle central dans ce processus en catalysant l'oxydation de l'eau et en produisant du dioxygène grâce à la lumière du soleil, étape fondamentale de la photosynthèse oxygénée. Malgré des recherches approfondies, la dynamique structurelle du PSII au cours de la réaction de division de l'eau, en particulier au niveau atomique et sur des échelles de temps courtes, reste largement inexplorée.
Des recherches antérieures ont fourni des informations précieuses sur les changements structurels se produisant dans le PSII au cours de la réaction de division de l'eau, en se concentrant sur des échelles de temps allant de la microseconde à la milliseconde. Cependant, il y a un manque d'informations structurelles à haute résolution à des échelles de temps plus courtes, en particulier lors des transitions entre les différents états du complexe dégageant de l'oxygène (OEC) induites par l'excitation lumineuse, ce qui est essentiel pour comprendre le mécanisme d'oxydation de l'eau et de l'oxygène. évolution.
Pour combler cette lacune en matière de recherche, les professeurs Michihiro Suga et Jian-Ren Shen de l'Institut de recherche pour les sciences interdisciplinaires de la Graduate School of Environmental, Life, Natural Science and Technology de l'Université d'Okayama au Japon ont utilisé la cristallographie à rayons X femtoseconde en série pompe-sonde. (TR-SFX), une technique connue pour capturer les changements structurels ultrarapides des macromolécules biologiques avec une précision spatiale et temporelle remarquable.
Suivant les protocoles établis, les microcristaux PSII ont été méticuleusement préparés et soumis à une ou deux excitations lumineuses par flash laser, suivies d'un éclairage avec des impulsions de rayons X femtosecondes générées par un laser à électrons libres à rayons X (XFEL).
"Le processus de génération de microcristaux pour le photosystème II a pris beaucoup de temps, s'étalant sur près de cinq ans jusqu'à ce que les résultats soient compilés et publiés", a déclaré le professeur Michihiro Suga.
En exposant les cristaux à des flashs laser et en capturant des diagrammes de diffraction des rayons X à différents délais, les chercheurs ont pu suivre de manière approfondie les altérations structurelles mineures du PSII, allant de la nanoseconde à la milliseconde après l'illumination du flash.
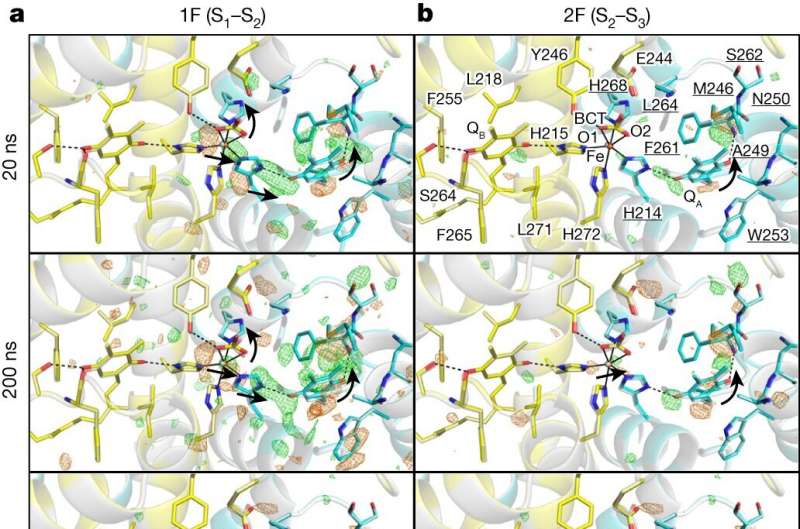
Les résultats, publiés dans Nature , révèlent la dynamique structurelle complexe du PSII lors des transitions cruciales du S1 à S2 et S2 à S3 États pour comprendre les événements cruciaux tels que le transfert d'électrons, la libération de protons et l'apport d'eau du substrat.
Après avoir exposé les cristaux à des éclairs laser, des altérations structurelles rapides dans le résidu de tyrosine YZ ont été observées, suggérant l'apparition de processus rapides de transfert d'électrons et de protons.
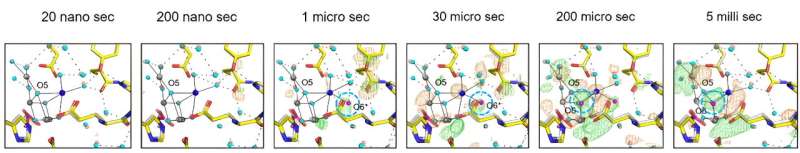
Une molécule d'eau proche de Glu189 de la sous-unité D1 a été trouvée immédiatement après deux éclairs, qui ont ensuite été transférées vers une position nommée O6 près de O5 comme précédemment trouvé, fournissant des informations précieuses sur l'origine de l'atome d'oxygène incorporé lors de la réaction de division de l'eau.
L'enquête a également clarifié les mouvements concertés des molécules d'eau dans des canaux spécifiques, élucidant leur rôle crucial dans la facilitation de l'apport d'eau du substrat et de la libération de protons. Ces observations mettent en lumière l'interaction complexe entre l'échafaudage protéique et les molécules d'eau, soulignant leur contribution synergique à l'efficacité du cycle catalytique du PSII.
« Les résultats de nos recherches ont des implications significatives dans divers domaines, notamment dans la conception de catalyseurs pour la photosynthèse artificielle. En élucidant les mécanismes moléculaires sous-jacents à l'oxydation de l'eau dans le PSII, nous pouvons inspirer le développement de catalyseurs synthétiques capables d'exploiter efficacement l'énergie solaire par voie artificielle. photosynthèse", explique le professeur Jian-Ren Shen.
Les chercheurs affirment qu'en comprenant la dynamique structurelle du PSII, nous pouvons également éclairer les stratégies d'optimisation des processus photosynthétiques naturels dans les cultures afin d'améliorer la productivité agricole et d'atténuer les effets du changement climatique. Ajoutant que ces découvertes approfondissent non seulement notre compréhension des processus biologiques fondamentaux, mais sont également extrêmement prometteuses pour relever les défis mondiaux urgents liés à la durabilité énergétique et à la conservation de l'environnement.
Plus d'informations : Hongjie Li et al, Structures du photosystème II évoluant en oxygène pendant les transitions S1 – S2 – S3, Nature (2024). DOI :10.1038/s41586-023-06987-5
Informations sur le journal : Nature
Fourni par l'Université d'Okayama