L’eau détermine la vie :les humains sont constitués aux trois quarts d’eau. Une équipe de recherche internationale dirigée par l'Université d'Amsterdam (UvA) a découvert comment l'eau détermine également la structure du matériau qui nous maintient ensemble :le collagène.
Dans un article publié dans PNAS , les chercheurs élucident le rôle de l'eau dans l'auto-assemblage moléculaire du collagène. Ils montrent qu'en remplaçant l'eau par sa « molécule jumelle », l'eau lourde (D2 O), on peut « régler » l’interaction entre les molécules de collagène, et ainsi influencer le processus d’auto-assemblage du collagène. Les résultats aideront à mieux comprendre les défaillances tissulaires résultant de maladies héréditaires liées au collagène, telles que la fragilité des os (ostéogenèse imparfaite).
Comme le dit l'auteur principal, le Dr Giulia Giubertoni de l'Institut Van 't Hoff pour les sciences moléculaires (HIMS) de l'UvA :« En étudiant ces maladies et d'autres maladies du collagène, de nombreux chercheurs, y compris moi-même, ... ont toujours manqué une partie importante de la énigmatique, et la possibilité que la défaillance des tissus puisse être en partie due à l'interaction eau-collagène n'a pas été prise très au sérieux. Nous montrons maintenant que la perturbation, même très légère, de la couche d'eau autour de la protéine a des effets dramatiques sur l'assemblage du collagène. "
Giubertoni souhaite faire prendre conscience aux chercheurs de la communauté des maladies du collagène que des changements très subtils dans l'interaction eau-collagène pourraient contribuer aux maladies du collagène. Ces changements peuvent potentiellement résulter, par exemple, de mutations dans la protéine de collagène qui surviennent lors de maladies génétiques. Les chercheurs suggèrent également que les interactions altérées entre l'eau et le collagène sont un facteur contribuant à diverses maladies liées à l'âge impliquant un dysfonctionnement des tissus.
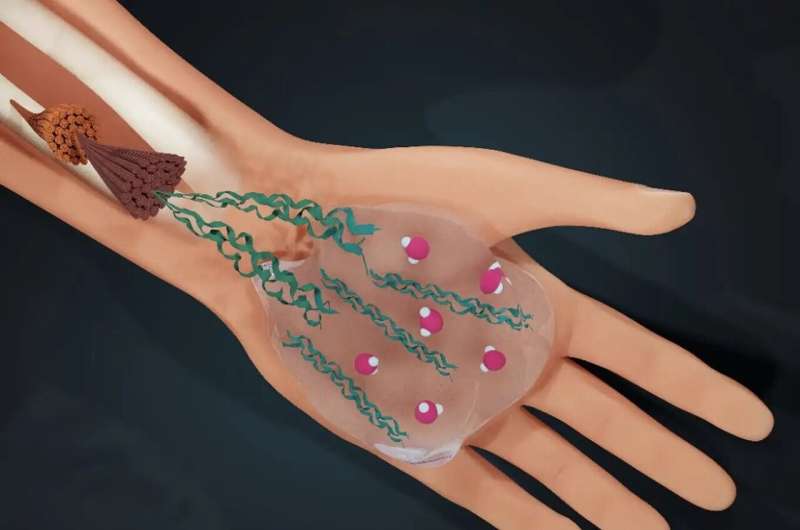
Le collagène est dans une large mesure « ce dont nous sommes constitués » :environ un tiers de toutes les protéines de notre corps sont du collagène qui garantit l'intégrité mécanique de tous les tissus conjonctifs humains.
Par exemple, notre peau et nos artères s’étirent sans se déchirer et nos os peuvent résister à des contraintes élevées sans se briser. Le collagène est produit par nos cellules sous forme de protéines uniques qui s’assemblent en structures plus grandes appelées fibrilles. Ces fibrilles s'assemblent ensuite en réseaux qui forment les échafaudages de nos tissus.
Puisque le collagène se forme dans le milieu aqueux des cellules humaines, l’eau joue un rôle crucial dans son assemblage. L’interaction des molécules d’eau avec les protéines donne naissance au collagène le mieux adapté à sa fonction. Mais qu’est-ce qui se cache exactement derrière ce rôle de l’eau dans l’optimisation du collagène ? Comment l’eau fait-elle ? Et la compréhension de ce mécanisme offrira-t-elle un aperçu des conditions dans lesquelles quelque chose ne va pas avec le collagène, comme l’ostéogenèse imparfaite ? Telles étaient les questions centrales de la recherche publiée dans PNAS .
Introduction à l'eau lourde
Pour étudier le rôle de l'eau dans la formation du collagène, Giubertoni, avec son collègue de l'UvA, le professeur Sander Woutersen, et leur collaborateur, le professeur Gijsje Koenderink (Université de technologie de Delft), ont décidé de remplacer l'eau par sa « molécule jumelle » plus lourde, D 2 O. Initialement découvert par le prix Nobel Harold Urey en 1931, en D2 O les atomes d'hydrogène (H) de l'eau sont remplacés par l'isotope deutérium (D) qui possède un neutron supplémentaire dans son noyau. D2 O ou « eau lourde » est donc le « remplacement le plus proche » de l'eau ordinaire dans la nature.
Cependant, en interaction avec les protéines, D2 O est moins puissant que H2 O. C'est parce que les liaisons entre D2 Les molécules O (appelées liaisons hydrogène) sont plus fortes que celles entre H2 Ô molécules. Cela affecte l'interaction avec des protéines telles que le collagène.
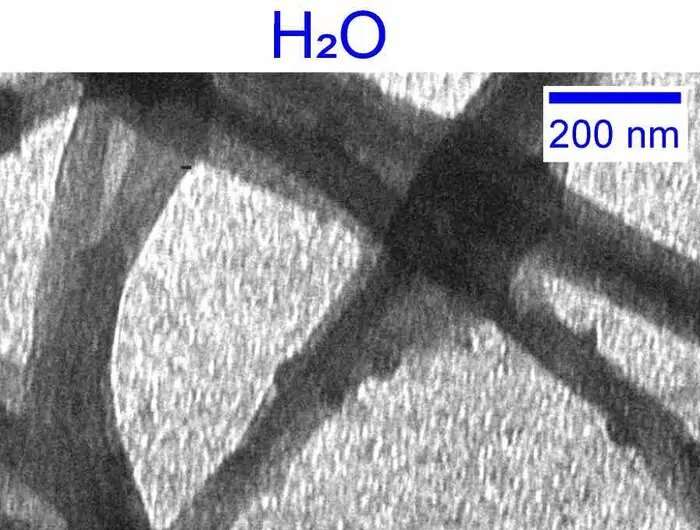
Giubertoni, Woutersen et Koenderink souhaitaient étudier l'effet que cela aurait sur l'assemblage du collagène. Grâce à un réseau de recherche collaboratif multidisciplinaire, ils ont pu établir que l'utilisation d'eau lourde entraîne une formation de collagène dix fois plus rapide et, finalement, un réseau de fibres de collagène moins homogène, plus doux et moins stable.
L'explication est que l'interaction réduite de l'eau lourde avec la protéine de collagène permet à la protéine de « se débarrasser » plus facilement du D2. O molécules et se réorganise.
Cela stimule la formation du réseau de collagène, mais entraîne également un réseau de collagène plus bâclé et moins optimal. L'eau agit ainsi comme médiateur entre les molécules de collagène, ralentissant l'assemblage pour garantir les propriétés fonctionnelles des tissus vivants.
Cette découverte offre de nouvelles perspectives sur la manière dont l’eau influence les caractéristiques du collagène, permettant des ajustements précis des propriétés mécaniques des tissus vivants. Cela crée également de nouvelles voies pour créer des matériaux à base de collagène où les propriétés macroscopiques peuvent être contrôlées et affinées par des variations subtiles dans la composition du solvant, plutôt que par des changements significatifs dans la structure chimique des éléments constitutifs moléculaires.
Une approche « investigative » similaire pourrait également être utilisée à l’avenir pour élucider le rôle de l’eau dans la conduite et le guidage de l’assemblage d’autres protéines capables de s’assembler dans des structures plus grandes. Giubertoni étudiera ensuite comment les défauts du collagène affectent son interaction avec l'eau et quel rôle cela joue dans la défaillance des tissus dans les maladies du collagène.
Plus d'informations : Giulia Giubertoni et al, Élucider le rôle de l'eau dans l'auto-assemblage du collagène en modulant isotopiquement l'hydratation du collagène, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2313162121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'Université d'Amsterdam