Certains types de peptides et de microprotéines destinés à la recherche sur la découverte de médicaments peuvent être fabriqués plus efficacement et plus rapidement à l'aide d'un solvant de réaction qui aide à imiter les méthodes naturelles.
Les chimistes peuvent désormais produire de manière plus fiable et beaucoup plus rapide une classe importante de petites protéines appelées peptides riches en cystéine dans leur structure 3D naturellement repliée, grâce à des méthodes qui imitent ce qui se passe à l’intérieur des cellules. Cette avancée, réalisée par des chercheurs de l'Université Xi'an Jiaotong-Liverpool (XJTLU) en Chine et de l'Université technologique de Nanyang (NTU) à Singapour, est publiée dans la revue Angewandte Chemie. .
La cystéine est l’une des nombreuses molécules d’acides aminés qui peuvent s’unir pour former des chaînes protéiques. Les peptides sont des chaînes plus courtes que de nombreuses protéines naturelles. Les molécules de cystéine contiennent chacune un atome de soufre qui peut se lier au soufre d'une autre cystéine ailleurs dans une protéine, maintenant ensemble différentes parties de la chaîne.
"Recréer les formes 3D des peptides riches en cystéine a toujours été un gros problème dans leur fabrication", explique le Dr Shining Loo de l'équipe XJTLU. De nombreuses protéines et peptides bioactifs possèdent de multiples liaisons disulfure entre les acides aminés de cystéine, qui sont essentielles au maintien de leur structure repliée en 3D précise. Des médicaments comme le linaclotide pour la constipation et le ziconotide pour la douleur chronique sont des exemples de médicaments peptidiques riches en cystéine disponibles sur le marché.
"Notre procédure devrait ouvrir de nouvelles opportunités pour la découverte de médicaments et la fabrication rentable de microprotéines et de peptides riches en cystéine en tant qu'agents thérapeutiques", ajoute le chercheur Dr Antony Kam de l'équipe XJTLU.
L'influence de la nature
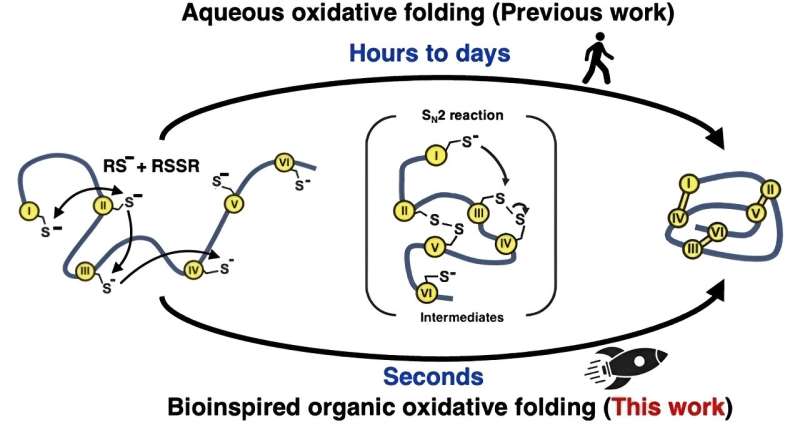
Inspirés par la façon dont la nature replie rapidement les protéines à l'intérieur des cellules, les chercheurs ont essayé une approche différente pour les réactions de repliement « oxydatives » qui forment les liaisons disulfure. Au lieu d’utiliser des solutions à base d’eau (aqueuses), ils ont utilisé un mélange de solvants organiques. Cette méthode imite l'enzyme naturelle qui intervient dans la formation des liaisons disulfure, en créant un environnement hautement réactif pour accélérer considérablement la formation et le réarrangement de ces liaisons.
En apprenant de la nature de cette manière, l'équipe a pu fabriquer 15 peptides et microprotéines différents, d'une longueur comprise entre 14 et 58 acides aminés et comportant deux à cinq liaisons disulfure, à des vitesses plus de 100 000 fois plus rapides que celles qui pourraient être obtenues dans des solvants aqueux. /P>
"Le repliement a été réalisé efficacement en une seconde", remarque le Dr Loo, "Et la gamme de microprotéines que nous avons produites démontre que notre méthode devrait être efficace avec une gamme beaucoup plus large de peptides et de microprotéines dans les recherches futures."
Cette découverte est la dernière avancée du groupe de recherche XPad (XJTLU Peptide and Drug), créé conjointement par le Dr Loo et le Dr Kam. Ce groupe s'engage à utiliser des outils issus de la biologie chimique, de la biologie synthétique et de la pharmacologie moléculaire pour faire progresser l'application des peptides pour le développement d'agents thérapeutiques.
"L'avenir de la recherche sur les peptides est très prometteur et nous nous engageons à réaliser des progrès encore plus précieux dans ce domaine", conclut le Dr Kam.
Plus d'informations : Antony Kam et al, Repliement oxydatif biomimétique ultrarapide de peptides et de microprotéines riches en cystéine dans des solvants organiques, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317789
Informations sur le journal : Angewandte Chemie , Angewandte Chemie International Edition
Fourni par Xi'an Jiaotong-Université de Liverpool