Des scientifiques de l'Université d'Oulu (Finlande) et de la Texas A&M University (États-Unis) ont développé une nouvelle méthode pour étudier comment les protéines interagissent avec de petites molécules de ligands, ouvrant ainsi la voie, par exemple, à une découverte de médicaments plus rapide et plus efficace.
Cette interaction, connue sous le nom d’interaction protéine-ligand, est cruciale pour de nombreux processus biologiques, mais son étude est traditionnellement lente et insensible. La nouvelle méthode, décrite dans le Journal of the American Chemical Society , combine deux techniques avancées pour surmonter ces limitations.
Une méthode a le potentiel de révolutionner notre compréhension des interactions protéiques dans le cadre de la communication continue des cellules. Ces interactions et les perturbations qui peuvent survenir peuvent jouer un rôle important par exemple dans le développement de maladies auto-immunes et de maladies neurodégénératives comme la maladie d'Alzheimer. Par exemple, des interactions dysfonctionnelles peuvent également conduire à une croissance cellulaire agressive et au cancer.
"La méthode que nous avons développée pourrait accélérer considérablement le développement de nouveaux médicaments et nous aider à mieux comprendre les mécanismes de nombreuses maladies", déclare le Dr Otto Mankinen de l'unité de recherche RMN de l'université d'Oulu.
La première technique, l’hyperpolarisation par polarisation nucléaire dynamique de dissolution (d-DNP), agit comme un amplificateur de signal, améliorant considérablement le signal de la molécule de ligand étudiée. Surtout lors de l'étude de faibles quantités de substances et de noyaux de faible abondance tels que le carbone 13, l'hyperpolarisation est un outil crucial pour rendre le signal observable.
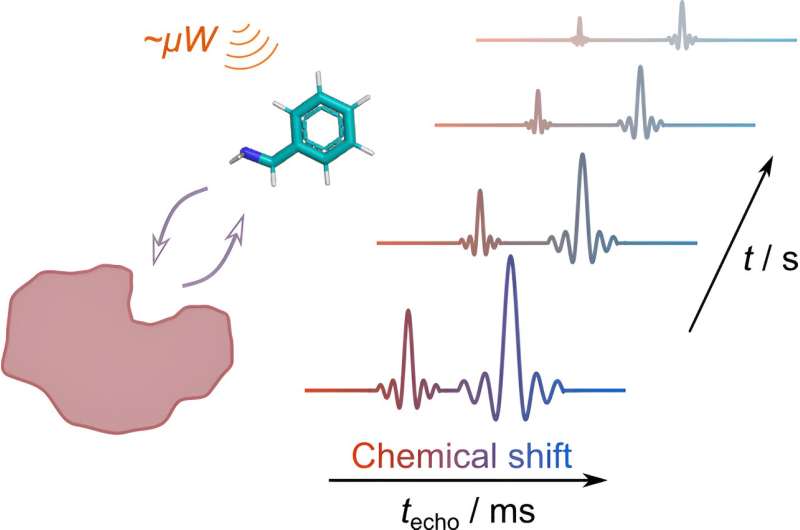
La deuxième technique, Ultrafast NMR, permet d’utiliser l’hyperpolarisation dans la mesure de données RMN multidimensionnelles. Les mesures RMN multidimensionnelles conventionnelles nécessitent plusieurs répétitions pour collecter des données complètes.
Dans l’approche ultrarapide, l’une des dimensions est codée le long du volume de l’échantillon en couches, avec une méthode appelée codage spatial. Après l'encodage, les informations sont lues selon les principes de l'imagerie par résonance magnétique (IRM). Dans ce cas, le spectre RMN a été codé spatialement, puis l'atténuation du signal dans le temps a été surveillée pour plusieurs pics spectraux.
En combinant ces techniques, les chercheurs peuvent désormais obtenir des informations détaillées sur la liaison protéine-ligand en une seule expérience pour plusieurs signaux de ligand. L'approche conventionnelle est limitée à un seul signal par mesure. Cela ouvre la porte à une découverte de médicaments plus efficace en permettant aux scientifiques de mieux comprendre comment les molécules médicamenteuses potentielles interagissent avec leurs cibles protéiques.
Plus d'informations : Chang Qi et al, Mesure de la liaison protéine-ligand par RMN ultra-rapide hyperpolarisée, Journal of the American Chemical Society (2024). DOI : 10.1021/jacs.3c14359
Informations sur le journal : Journal de l'American Chemical Society
Fourni par l'Université d'Oulu