L'atome est l'unité la plus élémentaire de tout élément qui conserve encore les propriétés de cet élément. Parce que les atomes sont beaucoup trop petits pour être vus, leur structure a toujours été un mystère. Pendant des milliers d'années, les philosophes et les scientifiques ont proposé des théories concernant la composition de cette mystérieuse particule, avec des degrés de sophistication croissants. Bien qu'il existe de nombreux modèles, quatre principaux ont conduit à notre concept actuel de l'atome.
Le modèle de pudding aux prunes
Le soi-disant modèle de pudding aux prunes a été proposé par le scientifique J.J. Thomson en 1904. Ce modèle a été conçu après la découverte par Thomson de l'électron comme une particule discrète, mais avant que l'on comprenne que l'atome avait un noyau central. Dans ce modèle, l'atome est une boule de charge positive - le pudding - dans laquelle se trouvent les électrons - les prunes -. Les électrons tournent dans des trajectoires circulaires définies dans la goutte positive qui constitue la majorité de l'atome.
Modèle Planétaire
Cette théorie a été proposée par le chimiste lauréat du prix Nobel Ernest Rutherford en 1911 et est parfois appelée Modèle Rutherford. Sur la base d'expériences qui ont montré que l'atome semblait contenir un petit noyau de charge positive, Rutherford a postulé que l'atome se composait d'un petit noyau dense et chargé positivement, autour duquel les électrons tournaient en orbite autour d'anneaux circulaires. Ce modèle a été l'un des premiers à proposer l'idée étrange que les atomes sont principalement constitués d'espace vide à travers lequel les électrons se déplacent.
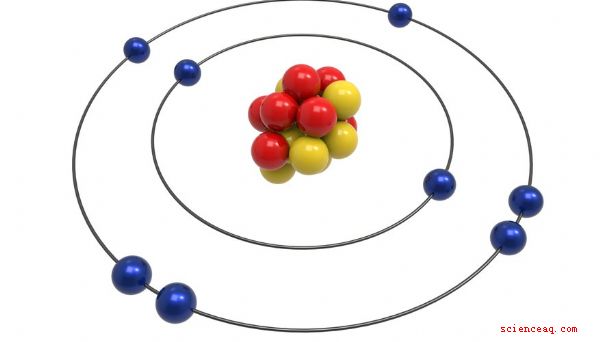
Modèle de Bohr
Le modèle de Bohr a été conçu par Neils Bohr, un physicien de Danemark qui a reçu le prix Nobel pour son travail sur l'atome. À certains égards, il s'agit d'une amélioration plus sophistiquée du modèle Rutherford. Bohr a proposé, tout comme Rutherford, que l'atome ait un petit noyau positif où la majeure partie de sa masse résidait. Il a déclaré que les électrons tournaient autour de ce noyau comme des planètes autour du soleil. La principale amélioration du modèle de Bohr était que les électrons étaient confinés pour définir des orbites autour du noyau, chacune ayant un niveau d'énergie spécifique, ce qui expliquait les observations expérimentales telles que le rayonnement électromagnétique.
Modèle de nuage d'électrons
Le nuage d'électrons Le modèle est actuellement le modèle d'atome le plus sophistiqué et le plus largement accepté. Il conserve le concept de noyau des modèles de Bohr et Rutherford, mais introduit une définition différente du mouvement des électrons autour du noyau. Le mouvement des électrons autour du noyau dans ce modèle est défini par des régions où il y a une plus grande probabilité de trouver l'électron à un moment donné. Ces régions de probabilité autour du noyau sont associées à des niveaux d'énergie spécifiques et prennent diverses formes étranges à mesure que l'énergie des électrons augmente.