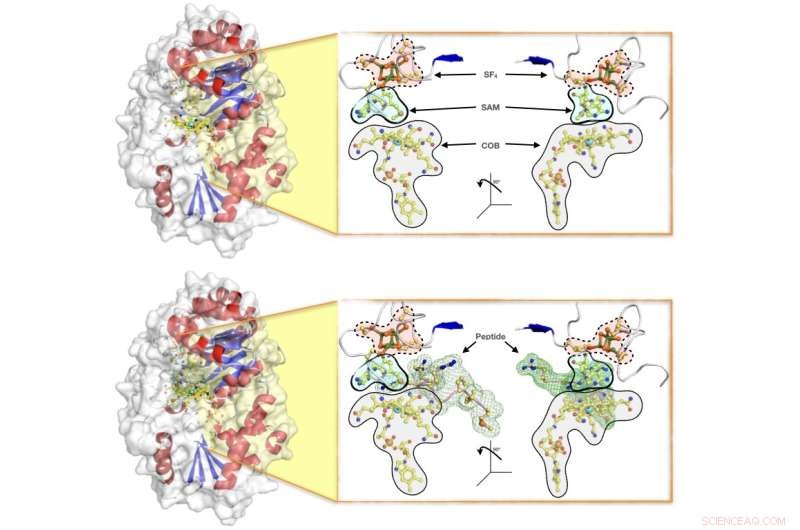
Illustrations de surface de l'enzyme Mmp10, montrant (en haut) la protéine avec l'ensemble complet de cofacteurs nécessaires à la réaction enzymatique (à savoir :le cluster SF4, le SAM et la cobalamine COB), et (en bas) l'enzyme dans action tout en accueillant le peptide pour le transfert de méthyle. L'équipe de recherche a élucidé les détails cristallographiques de la réaction et proposé un mécanisme par lequel la protéine active une protéine partenaire qui constitue un contributeur majeur à la production naturelle de méthane chez les archées, qui représente environ les deux tiers de la production mondiale de méthane. Crédit :Léo Chavas
Alors que le méthane représente environ 16% de l'abondance dans l'atmosphère des gaz à effet de serre - qui comprennent également le dioxyde de carbone, l'oxyde nitreux, la vapeur d'eau - il est plus de 25 fois meilleur que le dioxyde de carbone pour piéger la chaleur. On pense que les deux tiers de la libération mondiale de méthane se font par émission naturelle au cours de l'activité anaérobie de micro-organismes unicellulaires primitifs appelés archées. Comprendre le mécanisme précis par lequel les archées produisent du méthane pourrait conduire à une technologie qui réduit la production de méthane par les archées et aide à lutter contre le réchauffement climatique.
Les archées se distinguent des bactéries principalement par leur habitat et leurs sources d'énergie. Les soi-disant archées méthanogènes émettent du méthane comme sous-produit de la production d'énergie nécessaire à leur survie. La biomolécule responsable de la formation de méthane est la protéine dite Methyl-Coenzyme M Reductase (ou MCR) qui induit la conversion chimique. Pour que le MCR catalyse cette réaction réversible, il doit être activé par une protéine partenaire appartenant à la superfamille des enzymes radicalaires S-adénosyl-L-méthionine (ou SAM) dépendantes de B12.
La superfamille des enzymes SAM radicales contient plus de 200 000 protéines séquencées indépendamment. Il a été associé à une multitude de processus naturels, dont la biosynthèse des antibiotiques et de la chlorophylle. L'une de ces enzymes clés (Mmp10) est responsable de l'activation de la protéine MCR et est donc impliquée dans la régulation de sa formation de méthane. L'omniprésence des enzymes SAM dans la biosphère reflète leur importance dans la catalyse de réactions fondamentales pour tous les types de vie. Cependant, les mécanismes équilibrant leurs activités biologiques restent mal compris.
Pour décrypter les activités de l'enzyme Mmp10 SAM, le Dr Olivier Berteau, de l'Institut Micalis de l'Université Paris-Saclay, a réuni une équipe d'experts scientifiques aux compétences variées et complémentaires, dont d'autres chercheurs de cette université, Aix Marseille Université et Synchrotron SOLEIL en France, ainsi que l'Université de Nagoya au Japon. Les résultats de l'enquête ont été publiés en ligne dans la revue Nature le 2 février 2022.
La clé de l'activité des enzymes SAM radicales dépendantes de B12 est un mécanisme simple mais puissant pour déclencher la réaction catalytique. La difficulté à faire en sorte que l'enzyme s'adapte simultanément à tous les acteurs impliqués dans la réaction a signifié que peu d'informations structurelles étaient disponibles pour aider à expliquer le fonctionnement de la réaction.
Pour remédier à cela, l'équipe de recherche a combiné des résultats cristallographiques avec des données biochimiques et biophysiques pour expliquer comment les protéines SAM radicales dépendantes de B12 régulent leur activité, jusqu'aux détails au niveau atomique. Le mécanisme enzymatique de Mmp10 a été imagé avec tous les acteurs de la réaction présents.
Les résultats de cette recherche ont des implications pour le développement de biotechnologies qui permettraient de contrôler des événements enzymatiques clés, notamment ceux impliqués dans l'émission de méthane, contribuant à la lutte contre le réchauffement climatique.
Le co-auteur, le professeur Leo Chavas, de l'Université de Nagoya, est enthousiasmé par les résultats de cette enquête à long terme. "Au total, 137 protéines ont été criblées dans une installation synchrotron de premier plan en France pour avoir un aperçu de ces événements rares, si difficiles à détecter. Cette recherche ouvre également la porte aux développements biotechnologiques."