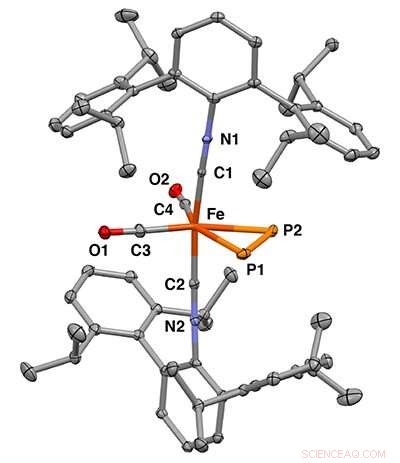
Structure cristalline aux rayons X du complexe mononucléaire fer η2-diphosphore. Crédit :Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University
Les éléments du tableau périodique des éléments sont répertoriés de manière à mettre l'accent sur certaines relations. Il existe des familles, des périodes (les lignes horizontales) et des groupes (les colonnes verticales). Les éléments au sein de chacun de ces groupes présentent certains points communs.
Des relations diagonales dans le tableau périodique existent entre deux éléments en position diagonale l'un par rapport à l'autre qui présentent des propriétés chimiques similaires. Le lithium et le magnésium, le bore et le silicium, le carbone et le phosphore en sont tous des exemples.
Une relation diagonale emblématique est depuis longtemps reconnue entre le carbone et le phosphore, en particulier dans les cas où des liaisons multiples élément-élément sont présentes, comme le diphosphore (P2 ) dans lequel deux atomes de phosphore sont reliés par une triple liaison faible.
Cette relation diagonale entre le phosphore et le carbone a créé l'attente selon laquelle la molécule de diphosphore devrait imiter les attributs de l'hydrocarbure acétylène (C2 H2 ). Par exemple, le diphosphore et l'acétylène réagissent avec d'autres molécules organiques via leurs liaisons pi, un type de liaison covalente que l'on trouve dans les molécules à liaisons multiples.
Un complexe de coordination est constitué d'un atome central ou d'un ion qui est généralement métallique et est entouré de molécules ou d'ions liés, appelés ligands ou agents complexants. Les complexes de coordination sont vitaux pour la vie sur terre et comprennent l'hémoglobine et la chlorophylle. Ils sont également largement utilisés dans les applications industrielles comme catalyseurs.
Bien que l'acétylène ait une chimie de coordination bien documentée avec des métaux de transition uniques, les complexes de coordination qui comportent du diphosphore lié à un seul centre métallique sont restés insaisissables.
Récemment, des chercheurs de l'Université de Californie à San Diego, de l'Université de Rochester et de l'Ohio State University ont rapporté la liaison du diphosphore à un seul centre métallique. Ce travail apparaît dans le numéro du 25 mars de Science .
Le diphosphore, contrairement à l'acétylène, est très instable et réactif. Lorsqu'il est généré sous forme libre, le diphosphore polymérise ou réagit rapidement avec les molécules de substrat présentes. En d'autres termes, le diphosphore ne reste pas longtemps diphosphore, sa nature est de se combiner avec d'autres éléments et molécules. Cela le rend difficile à étudier ou à manipuler.
Plusieurs voies de synthèse ont été établies pour former des complexes diphosphorés multinucléaires. La méthode la plus populaire consiste à séparer le tétraèdre P4 molécule, plus communément appelée phosphore blanc. Cependant, le phosphore blanc est toxique et hautement inflammable (c'était un composant principal de nombreuses bombes incendiaires utilisées pendant la Seconde Guerre mondiale).
"Le travail présenté ici fournit une stratégie synthétique pour accéder aux complexes mononucléaires de diphosphore en laboratoire", a déclaré Joshua Figueroa, professeur de chimie et de biochimie à l'UC San Diego, chercheur principal et co-auteur de l'article. "Nous prévoyons que ce mode de coordination pourrait permettre le développement de réactions sélectives de transfert d'atomes de phosphore vers des molécules organiques."
Lors de la conception de l'expérience, Shuai Wang, chercheur postdoctoral à Figueroa et à l'UC San Diego, a utilisé le fer comme ion métallique, car il fournissait une bonne plate-forme de coordination permettant la liaison efficace de petites molécules. En liant le diphosphore à un ion de fer, ils ont pu assembler les deux atomes de phosphore d'une manière qui contournait la libération libre de diphosphore, offrant une stabilité très recherchée.
Wang, qui est le premier auteur de l'article et a effectué le travail de synthèse, a déclaré :« Compte tenu de l'extrême sensibilité de la molécule de diphosphore libre en tant qu'espèce éphémère, il est remarquable de constater à quel point elle devient stable lors de la coordination avec le centre de fer mononucléaire stériquement encombré. "
Les chercheurs ont utilisé la cristallographie aux rayons X pour déterminer la structure 3D précise des molécules et la spectroscopie Mossbauer pour observer les changements dans les interactions de liaison entre l'ion fer et le diphosphore. Il s'agissait d'une technique clé car elle a permis aux chercheurs de montrer que le diphosphore et une molécule d'acétylène influençaient les propriétés du centre de fer de manière similaire.
Si le diphosphore peut exister sous une forme relativement stable et sélectivement réactive, les scientifiques pourront le fixer à des substrats dans ce que l'on appelle la chimie du "clic". La chimie du clic ne décrit pas une réaction unique et spécifique, mais décrit une manière de générer des substances en joignant de petites unités modulaires. Cela pourrait ouvrir de nouveaux domaines de découverte en chimie de synthèse pour la préparation de composés pharmaceutiques.
"Nous sommes enthousiasmés par ce travail car il démontre l'importance d'utiliser les concepts fondamentaux appris en chimie de première année pour guider les nouvelles découvertes", a déclaré Figueroa. Nouvel ion aromatique inorganique