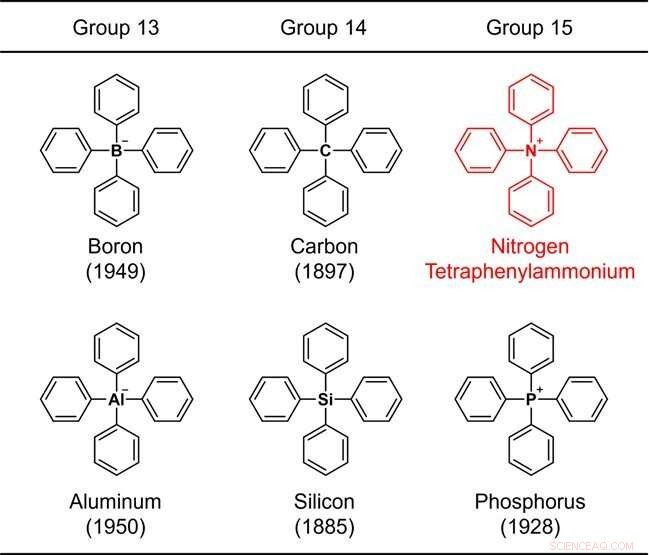
Figure 1. Structures des éléments tétraphényl-substitués appartenant aux groupes 13–15. Le nombre entre parenthèses indique l'année de synthèse. Crédit :Université de Kanazawa
Tétraphénylammonium, avec les quatre hydrogènes d'ammonium (NH4 + ) remplacé par des noyaux benzéniques, n'a été ni découvert dans la nature ni synthétisé chimiquement, ce qui remet en question son existence. Ici, nous avons réussi à synthétiser le tétraphénylammonium pour la première fois, démontrant son existence stable. La stratégie de synthèse utilisée dans cette étude, le couplage radicalaire, peut être applicable à la synthèse de divers ammoniums apparentés à haute nouveauté structurale. L'étude est publiée dans Nature Communications .
Étant donné que le cycle benzénique est un constituant représentatif des composés organiques, une structure constituée uniquement d'un élément commun plus le cycle benzénique est considérée comme l'un des squelettes chimiques les plus fondamentaux. En raison de leur importance, la synthèse chimique de telles molécules a été étudiée depuis les débuts de la chimie organique. Par exemple, la structure dans laquelle quatre cycles benzéniques sont liés à un élément représentatif (bore, carbone, aluminium, silicium ou phosphore) des groupes 13 à 15 du tableau périodique (Fig. 1) a été synthétisée il y a plus de 70 ans, et le rapport synthétique le plus ancien date de 137 ans.
Ces squelettes sont collectivement appelés "tétraphényle", ce qui signifie que la structure contient 4 cycles benzéniques. Lorsque l'élément central est l'azote, l'ammonium, le NH4 + , est considéré comme l'ion parent. Un tel composé est appelé tétraphénylammonium. Ce composé, en fait un ion, a une structure chimique très simple que même un débutant en chimie organique peut facilement imaginer.
Néanmoins, il s'est avéré très difficile de créer artificiellement cette structure, et aucun rapport synthétique avec une identification claire de la structure n'a été publié. De plus, comme il n'a pas été découvert dans la nature, il n'a pas été clair jusqu'à présent si le tétraphénylammonium peut exister. Des publications sont apparues qui supposent son existence et ne mentionnent que son utilisation sans décrire sa synthèse ou son mode d'acquisition. Les bases de données de composés contiennent uniquement la structure chimique. Ainsi, cet ion est parfois désigné comme s'il était déjà connu. Cependant, en réalité, personne ne l'a réellement observé, faisant du tétraphénylammonium un "ion fantôme".
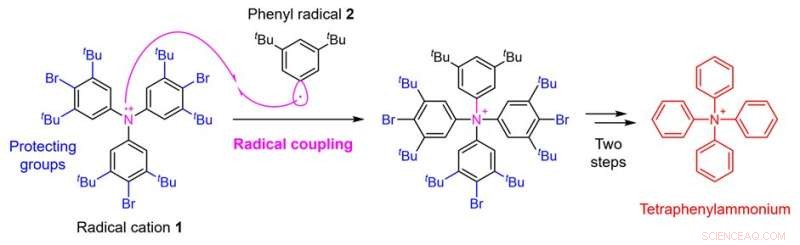
Figure 2. Stratégie de synthèse de tétraphénylammonium utilisant le couplage radicalaire. Crédit :Université de Kanazawa
Dans cette étude, une équipe de recherche de la Faculté des sciences pharmaceutiques de l'Université de Kanazawa a permis la synthèse de tétraphénylammonium en établissant une nouvelle stratégie de synthèse. Le point critique dans la synthèse du tétraphénylammonium est l'ajout du quatrième groupe phényle à l'atome d'azote auquel sont déjà attachés trois groupes phényle. On pensait qu'il était difficile de réaliser cette synthèse avec des techniques conventionnelles. Dans la présente étude, l'équipe de recherche a donc appliqué une technique appelée couplage radicalaire et utilisé une stratégie de réaction du cation radical 1 préparé à partir d'un dérivé de triphénylamine avec le radical phényle 2 (Fig. 2).
En conséquence, bien que le rendement soit aussi faible que 0,1 %, l'équipe de recherche a réussi à effectuer la conversion chimique souhaitée. Dans de tels couplages radicalaires, les radicaux hautement réactifs forment des liaisons entre eux, ce qui présente l'avantage de permettre la formation de liaisons qui ne pourraient pas être réalisées par d'autres méthodes. En revanche, il présente l'inconvénient qu'il est difficile de contrôler la sélectivité car la réactivité est trop élevée, entraînant diverses réactions secondaires.
Par conséquent, dans cette synthèse, afin de supprimer autant que possible la réaction secondaire de formation de liaison sur le carbone du radical cation 1, l'équipe de recherche a également imaginé l'introduction de groupes protecteurs) qui provoquent un encombrement stérique. Enfin, un total de cinq étapes de conversion chimique d'un dérivé de triphénylamine connu, le matériau de départ pour la synthèse, ont été réalisées par l'introduction des groupes protecteurs, le couplage radicalaire et l'élimination ultérieure des groupes protecteurs, conduisant au tétraphénylammonium.

Figure 3. Structure cristalline aux rayons X du tétraphénylammonium. Crédit :Université de Kanazawa
Sur la base des données obtenues à partir de diverses analyses instrumentales, la structure du tétraphénylammonium a été confirmée. La cristallographie aux rayons X) a révélé que la longueur de la liaison entre l'atome d'azote et l'atome de carbone du groupe phényle contenu dans cet ion n'est que de 1,529 Å (Fig. 3).
Étant donné que cette longueur de liaison est plus courte que celle d'une structure tétraphényle contenant un autre élément (bore, carbone, aluminium, silicium ou phosphore), il est évident que l'atome d'azote du tétraphénylammonium se trouve dans un environnement plus encombré spatialement que les autres éléments. Cette gêne tridimensionnelle est considérée comme l'un des facteurs qui rendent difficile la construction de ce squelette. De plus, nos résultats ont également révélé que le tétraphénylammonium a une stabilité élevée pour résister à des conditions fortement acides et basiques.
La présente étude a démontré que le tétraphénylammonium existe bel et bien et peut être synthétisé chimiquement. Si la synthèse à grande échelle de cet ion et de ses dérivés est réalisée à l'avenir, il pourrait potentiellement être appliqué dans divers domaines de recherche en tant que cation organique à haute stabilité chimique. De plus, la stratégie de couplage radicalaire utilisée dans cette étude peut être applicable à la synthèse d'autres ammoniums apparentés qui n'ont pas pu être fabriqués jusqu'à présent. Formation de radicaux aryle par clivage de la liaison halogénure d'aryle par un catalyseur carbène N-hétérocyclique