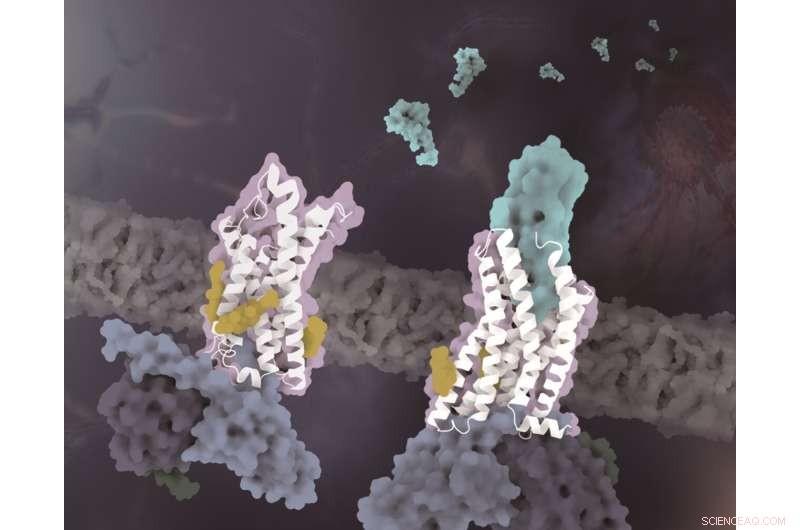
Les structures de CX3CR1 dans des états conformationnels distincts. Le CX3CR1 à la fois à l'état sans ligand et à l'état lié à CX3CL1 est coloré en blanc. Le CX3CL1 est coloré en cyan, les cholestérols sont colorés en jaune et les trois sous-unités de la protéine G sont colorées respectivement en bleu clair, bleu foncé et vert foncé. Crédit :Laboratoire de Zhao Qiang au SIMM
Les récepteurs de chimiokines régulent la migration des cellules immunitaires et sont impliqués dans l'inflammation, la construction tumorale et l'infection par des agents pathogènes. Les chimiokines sont divisées en quatre sous-familles selon le nombre et la distribution des cystéines conservées à l'extrémité N-terminale :CC, CXC, CX3C et XC.
Les chimiokines reconnaissent leurs récepteurs dans la même sous-famille, ce qui complique le développement de médicaments ciblés. En tant que seul membre de la sous-famille des récepteurs de chimiokines CX3C, CX3CR1 présente un avantage unique en tant que cible médicamenteuse potentielle dans le traitement de l'athérosclérose, du cancer et de la neuropathie. Cependant, le développement du médicament CX3CR1 est partiellement entravé par le manque d'informations structurelles qui régissent la reconnaissance des chimiokines et l'activation des récepteurs.
Dans une étude publiée dans Science Advances le 29 juin, une équipe de recherche dirigée par Zhao Qiang et Wu Beili du Shanghai Institute of Materia Medica (SIMM) de l'Académie chinoise des sciences, a fait une percée dans le domaine des récepteurs de chimiokines en résolvant les structures de cryo-microscopie électronique de CX3CR1 -Gi et complexes CX3CR1-CX3CL1-Gi.
Bien que plusieurs structures complexes de récepteurs de chimiokines dans les sous-familles CC et CXC aient été résolues, le mécanisme moléculaire de la reconnaissance unique de CX3CR1 et CX3CL1 reste inconnu. Avec l'analyse des structures et l'alignement des séquences, les chercheurs ont découvert que les caractéristiques structurelles uniques de la boucle 30s dans CX3CL1 et de la région ECL2 dans CX3CR1 jouent un rôle clé dans la reconnaissance avec le mécanisme de complémentarité de forme. Par rapport aux chimiokines CC et CXC, le motif CX3C spécifique de CX3CL1 entraîne un déplacement plus important de la boucle des années 30 vers le CX3CR1 ECL2.
Comme l'ECL2 de CX3CR1 contient moins de résidus que les autres récepteurs de chimiokines, de manière correspondante, l'ECL2 plus courte dans la structure CX3CR1-CX3CL1 fournit suffisamment d'espace pour la boucle de 30 s de CX3CL1. Cependant, la boucle des années 30 d'autres sous-familles de chimiokines présente une conformation non étendue, qui est complémentaire de la surface de l'ECL2 plus long des récepteurs correspondants.
C'est la première fois que des scientifiques fournissent la base structurelle pour élucider le mécanisme moléculaire de la reconnaissance spécifique entre CX3CR1 et son ligand endogène unique.
En plus de la spécificité de la reconnaissance du signal chimiotactique, une autre découverte importante de cette étude révèle que les molécules de cholestérol régulent l'activation de CX3CR1. Dans les structures complexes des états liés à CX3CL1 et activés de manière constitutive, on a observé que trois cholestérols stabilisaient l'hélice VI de CX3CR1 avec un changement de conformation beaucoup plus petit que les structures complexes GPCR-Gi de classe A précédemment résolues. Soutenus par les données fonctionnelles de CX3CR1 et d'autres récepteurs de chimiokines, les cholestérols sont en outre vérifiés pour jouer des rôles spécifiquement essentiels dans la stabilisation de la conformation et la transduction de signalisation de CX3CR1.
Cette étude donne un aperçu du mécanisme unique de reconnaissance des chimiokines pour la sous-famille des récepteurs de chimiokines humaines. Les sites distincts de liaison au cholestérol de CX3CR1 approfondissent nos connaissances sur la modulation des cholestérols dans les RCPG. Les scientifiques font une percée dans la compréhension des récepteurs de la sérotonine