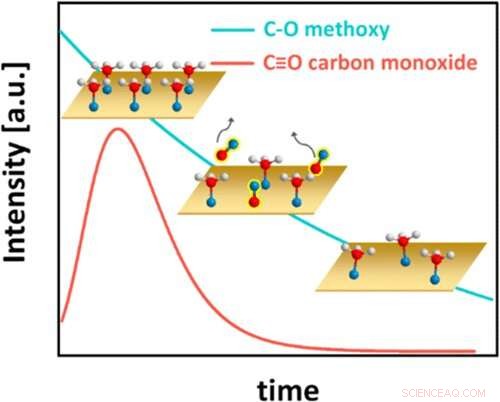
Résumé graphique. Crédit :ACS Catalyse (2022). DOI :10.1021/acscatal.1c05933
Des chercheurs de l'Institut Weizmann des sciences et du Laboratoire national de Brookhaven du Département américain de l'énergie (DOE) ont étudié la dynamique au niveau moléculaire en jeu lorsque le méthanol se transforme en hydrogène à l'aide d'un catalyseur au cuivre, l'ensemble du système étant à pression et température ambiantes. . Cette étude, qui a fourni des informations surprenantes sur le comportement du méthanol sur différentes surfaces de cuivre, aidera les chercheurs à trouver le catalyseur au cuivre le plus performant pour ce procédé et, plus largement, à approfondir leur compréhension des catalyseurs au cuivre en tant que groupe.
Le méthanol (un composé d'hydrogène, de carbone et d'oxygène) est un matériau polyvalent dans l'industrie de l'énergie. Il peut être utilisé comme carburant lui-même ou, comme dans cette recherche, pour produire un autre carburant :l'hydrogène. Le méthanol est un candidat de premier plan pour les technologies de stockage de l'hydrogène, en particulier dans les applications de pile à combustible automobile. Liquide à température ambiante, il est facile à travailler et compatible avec l'infrastructure essence existante. Il contient également une quantité relativement importante d'hydrogène en volume. Mais pour produire efficacement de l'hydrogène, le méthanol nécessite l'aide d'un catalyseur ainsi qu'une température relativement élevée.
Dans cette étude, décrite dans l'édition en ligne du 14 juin 2022 de ACS Catalysis , les chercheurs de Weizmann et Brookhaven ont étudié un système méthanol/cuivre - méthanol lié à la vapeur ou "adsorbé" sur une surface de cuivre - qui ne nécessitait pas de température élevée. Ils se sont concentrés sur la "décomposition du méthanol", la plus simple des quatre réactions qui peuvent produire de l'hydrogène à partir du méthanol. Parmi les catalyseurs possibles pour la réaction, ceux à base de cuivre (Cu) sont considérés comme les plus prometteurs. Cela est dû à plusieurs facteurs, notamment sa structure électronique favorable pour l'activité catalytique et son coût relativement faible et sa sécurité environnementale par rapport aux autres métaux. Pour mieux comprendre le rôle du Cu, il est essentiel que les scientifiques acquièrent une compréhension approfondie au niveau moléculaire de l'interaction entre la vapeur de méthanol et les surfaces de Cu.
Des chercheurs de Weizmann et du Center for Functional Nanomaterials (CFN), une installation utilisateur du DOE Office of Science à Brookhaven, ont examiné trois surfaces de Cu pour savoir comment le méthanol y adhère et comment il se comporte. Ces trois géométries de surface sont couramment étudiées en tant que catalyseurs en raison de la manière dont les atomes de Cu sont disposés, ce qui les rend plus disponibles pour interagir électroniquement avec d'autres composés. Le groupe a découvert que le méthanol agit de manière inattendue sur les trois surfaces.
"La tendance que nous avons constatée sur les trois surfaces était qu'une grande quantité de méthanol s'adsorbait au début, puis se séparait en différents composants qui se désorbaient. Après un certain temps, la couverture de méthanol a atteint un point d'équilibre", a déclaré Ashley Head, chercheur à l'Interface. Groupe Sciences/Catalyse du CFN et l'un des auteurs de l'article. "Nous n'avions jamais vu ce comportement auparavant et nous ne nous attendions pas à le faire."
Pour en étudier la dynamique, le groupe a utilisé à la fois des techniques de spectroscopie infrarouge (IR) et de rayons X, cette dernière réalisée au CFN.
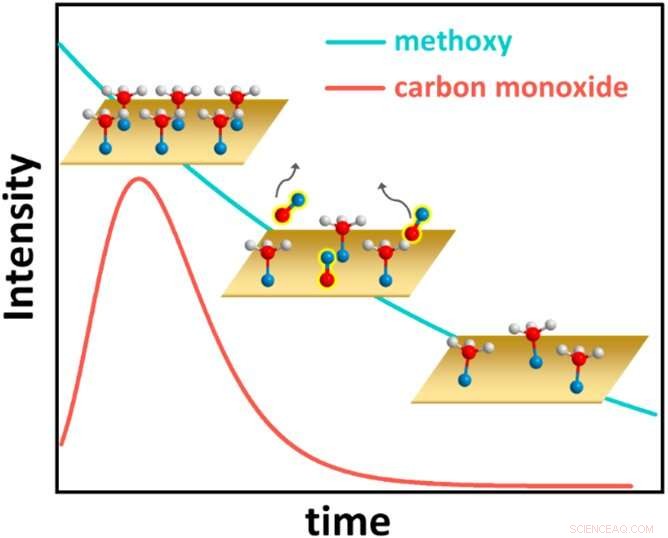
Cette figure illustre le comportement cinétique surprenant du système méthanol sur cuivre, avec des atomes d'hydrogène représentés sous forme de sphères blanches, des atomes d'oxygène sous forme de sphères bleues et des atomes de carbone sous forme de sphères rouges. Initialement, le méthanol recouvre complètement la surface du cuivre (Cu) (graphique en haut à gauche). Chaque molécule de méthanol perd alors un atome d'hydrogène et forme une liaison chimique avec le Cu, devenant une espèce carbone-oxygène connue sous le nom de méthoxy. Le méthoxy de surface, à son tour, réagit pour former du monoxyde de carbone (CO), qui se désorbe de la surface (graphique central, avec une couverture de CO au fil du temps représentée par la ligne rouge). La couverture en méthoxy diminue ensuite régulièrement (graphique en bas à droite et ligne bleue). Finalement, une couverture méthoxy d'équilibre est atteinte (non représentée). Crédit :Laboratoire national de Brookhaven
Le travail IR, mené à Weizmann, a fourni des informations sur les espèces chimiques de méthanol formées à la surface de Cu en mesurant la façon dont les molécules vibrent. Les vibrations spécifiques peuvent être liées à des composés spécifiques.
Les données IR ont indiqué que le méthanol s'adsorbait fortement sur le cuivre et formait une liaison directe avec le Cu, formant un composant chimique connu sous le nom de méthoxy. La couverture en méthoxy a ensuite progressivement diminué. Ce comportement a été observé sur les trois surfaces, avec des variations mineures.
"Ces dynamiques ne sont pas en accord avec ce que les modèles bien établis de ce système nous disent que nous devrions voir", a déclaré Baran Eren, chercheur au Département de physique chimique et biologique de Weizmann et auteur correspondant de l'article. "Au lieu de cela, l'évolution de la couverture en méthoxy avec le temps suit un modèle de cinétique d'adsorption extraordinaire."
Il a poursuivi :"Nous proposons qu'une forme de méthanol à courte durée de vie liée à l'hydrogène est la source de la couche méthoxy dense initiale."
Les informations tirées des données IR ont été confirmées au CFN, où le groupe a utilisé la spectroscopie photoélectronique à rayons X (APXPS). Dans cette technique, les rayons X dynamisent les électrons dans un échantillon, les faisant se libérer. Ces électrons éjectés transportent des informations précieuses. Dans ce cas, ils ont fourni des informations supplémentaires sur le comportement du méthanol à la surface de Cu et sur les conditions environnantes, en temps réel. APXPS permet aux chercheurs de calculer plus facilement les couvertures de molécules sur les surfaces que la spectroscopie IR.
Au fil du temps, l'excès de méthoxy a été éliminé à mesure que de plus en plus d'hydrogène était produit, laissant du monoxyde de carbone qui s'est désadsorbé du cuivre sous forme de gaz. Le méthoxy qui restait a atteint un point de couverture uniforme - un point d'équilibre. Notamment, la cinétique de ce processus était considérablement plus rapide sur la surface de Cu plus lâche que sur les deux autres, qui sont plus denses.
Dans les travaux futurs, le groupe prévoit de continuer à étudier les systèmes méthanol/Cu pour en savoir plus sur leur dynamique et si certains de ces comportements pourraient être trouvés dans des systèmes autres que le méthanol sur Cu. Pris en flagrant délit :identification des principaux intermédiaires chimiques dans la réaction polluant-carburant