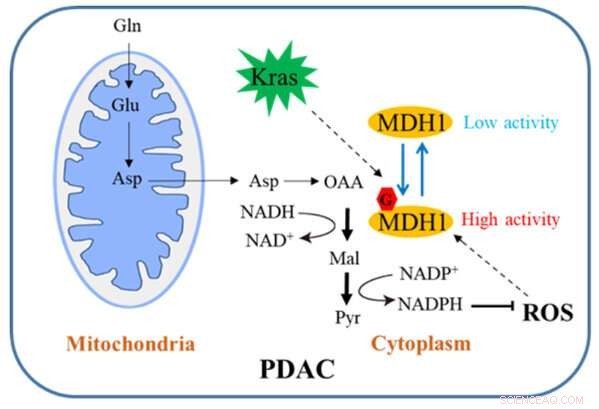
Diagramme schématique de la façon dont la glycosylation de MDH1 régule la croissance de PDAC. Crédit :Université du Zhejiang
Le cancer du pancréas est une tumeur extrêmement maligne du système digestif, et son taux de survie à cinq ans est d'un peu plus de 10 %. Les altérations métaboliques sont l'une des caractéristiques des cellules tumorales. Les cellules oncogènes de l'adénocarcinome canalaire pancréatique activé par Kras (PDAC) dépendent fortement d'une voie catabolique non conventionnelle de la glutamine (Gln) pour soutenir la croissance cellulaire.
Dans la voie conventionnelle, Gln est d'abord converti en aspartate (Asp), qui est transporté des mitochondries dans le cytosol, où il est converti séquentiellement par l'aspartate transaminase 1 (GOT1), MDH1 et l'enzyme malique 1 (ME1) en pyruvate et NADPH. Cette voie est essentielle pour que les cellules PDAC maintiennent l'homéostasie redox et est nécessaire pour la prolifération cellulaire et la croissance tumorale in vivo. Par conséquent, une compréhension approfondie de ce mécanisme de régulation pourrait bien ouvrir une nouvelle voie pour le traitement clinique de la PDAC.
L'équipe de recherche dirigée par le professeur Zhou Ruhong et le professeur Yi Wen du Zhejiang University College of Life Sciences a publié un article dans la revue Nature Chemical Biology le 25 juillet. Cet article révèle que la O-GlcNAcylation contribue à la croissance du cancer du pancréas en régulant l'activité métabolique de la malate déshydrogénase 1 (MDH1). Cette découverte a d'immenses implications pour le développement de médicaments contre les tumeurs pancréatiques.
L'équipe a mené des recherches pertinentes. Leur étude démontre que la mutation de Kras induit la β-N-acétylglucosamine cellulaire liée à l'O (O-GlcNAc), une forme répandue de glycosylation des protéines. La malate déshydrogénase 1 (MDH1), une enzyme clé de la voie catabolique de la glutamine, est régulée positivement par la O-GlcNAcylation sur la sérine 189 (S189).
Des simulations de dynamique moléculaire suggèrent que la glycosylation de S189 sur MDH1 monomère améliore la stabilité de la poche de liaison au substrat et renforce les interactions avec le substrat en servant de colle moléculaire. L'épuisement de la O-GlcNAcylation réduit l'activité MDH1, altère le métabolisme de la glutamine, sensibilise les cellules PDAC au stress oxydatif, diminue la prolifération cellulaire et inhibe la croissance tumorale chez les souris nude. De plus, les niveaux de O-GlcNAcylation de MDH1 sont élevés dans les échantillons cliniques de PDAC.
L'identification de voies et de protéines spécifiques avec une dépendance unique à l'O-GlcNAc est indispensable pour développer des thérapies ciblées. L'étude du professeur Zhou et du professeur Yi et al. révèle que la glycosylation de MDH1 est sur le point de réguler la voie métabolique unique de Gln dans PDAC, soulignant ainsi le potentiel d'intervention dans la glycosylation de MDH1 en tant que stratégie thérapeutique contre PDAC. Des scientifiques découvrent une molécule qui tue les cellules cancéreuses du pancréas