Mécanisme moléculaire sous-jacent au changement structurel de la protéine de pointe SARS-CoV-2. Crédit :RIKEN
Un groupe de recherche du RIKEN Center for Computational Science (R-CCS) a découvert que les glycanes – des molécules de sucre – jouent un rôle important dans les changements structurels qui se produisent lorsque le virus qui cause le COVID-19 envahit les cellules humaines. Leur découverte, qui était basé sur des simulations basées sur un supercalculateur, pourrait contribuer à la conception moléculaire de médicaments pour la prévention et le traitement du COVID-19. La recherche a été publiée dans le Journal biophysique .
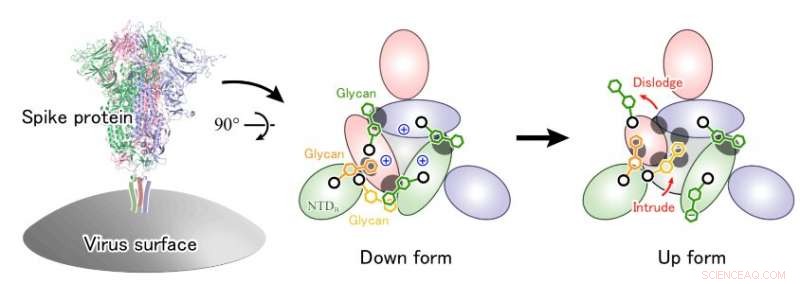
Lorsque le SRAS-CoV-2, le coronavirus qui cause le COVID-19, envahit une cellule humaine, une protéine de pointe à sa surface se lie à une enzyme appelée ACE2 à la surface de la cellule. La protéine de pointe se compose de trois chaînes polypeptidiques, et les glycanes, molécules de sucre, sont attachés à la surface de la protéine. Bien que ces glycanes soient censés être utilisés pour permettre aux protéines de se reconnaître, on pense également que les virus les utilisent pour échapper aux attaques des anticorps.
Des analyses structurelles ont montré que les protéines de pointe du SARS-CoV-2 ont des structures de forme descendante et montante. Ces analyses ont fait progresser notre compréhension de la structure tridimensionnelle des protéines de pointe, mais la structure moléculaire détaillée des glycanes très fluctuants n'est toujours pas comprise, et en fait le rôle des glycanes dans le processus d'invasion cellulaire reste incertain.
Pour mieux comprendre leur rôle, l'équipe de recherche dirigée par Yuji Sugita de R-CCS a mené des simulations de dynamique moléculaire pour les structures de forme descendante et montante des protéines, en utilisant deux supercalculateurs—Fugaku au R-CCS et Oakforest-PACS à l'Université de Tokyo. Grâce à ces puissantes machines, ils ont effectué des simulations de dynamique moléculaire des protéines de pointe à une échelle de temps de 1 microseconde (un millionième de seconde).
A partir des calculs, ils ont pu identifier des acides aminés spécifiques liés au glycane dans la protéine de pointe qui jouent un rôle important dans la stabilisation de la structure du domaine de liaison au récepteur. Leurs résultats suggèrent que le changement de conformation de la structure Up-form est entraîné par la répulsion électrostatique entre les domaines, et que les glycanes qui stabilisent la structure en forme de Down sont délogés et remplacés par d'autres glycanes après le déplacement des domaines. L'étude a ainsi fourni de nouvelles informations sur la façon dont les glycanes aident à stabiliser la structure dynamique des protéines.
Selon Sugita, « Nous devons développer de meilleurs traitements préventifs et thérapeutiques pour mettre fin à la pandémie. Il serait très utile de pouvoir concevoir des médicaments prenant en compte les changements structurels des protéines de pointe, en stabilisant la forme descendante ou en inhibant le passage à la forme montante, par exemple."
"Des projets de recherche comme celui-ci, " il ajoute, « montrez-nous comment la nouvelle génération de supercalculateurs puissants nous permettra d'acquérir de nouvelles connaissances sur de nombreux phénomènes en effectuant des simulations à un niveau de détail qui aurait été impossible auparavant. »