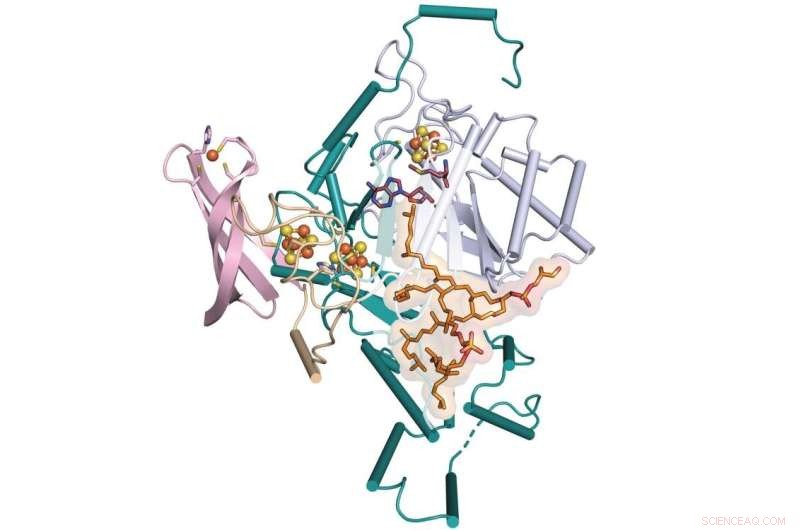
Une équipe de Penn State et de l'Université de l'Illinois à Urbana-Champaign a déterminé l'étape manquante dans la formation d'une molécule appelée GDGT, qui est un candidat prometteur à utiliser comme indicateur du climat passé. L'équipe a déterminé la structure cristalline aux rayons X d'une enzyme qui facilite ce processus appelé GDGT/MAS, montrée ici liée à des cofacteurs supplémentaires. Crédit :Booker Lab / État de Pennsylvanie
L'étape manquante dans la formation d'une molécule lipidique qui permet à certains organismes unicellulaires de survivre dans les environnements les plus extrêmes de la Terre est désormais déchiffrée. Cette nouvelle compréhension, découverte par une équipe de biochimistes de Penn State et de l'Université de l'Illinois à Urbana-Champaign, pourrait améliorer la capacité des lipides à être utilisés comme indicateur de température à travers le temps géologique.
Le lipide, appelé glycérol dibiphytanyl glycérol tétraéther (GDGT), se trouve dans la membrane cellulaire de certaines espèces d'archées, des organismes unicellulaires que l'on pensait à l'origine être des bactéries mais qui sont maintenant considérés comme un groupe distinct. Ce lipide offre la stabilité nécessaire à certaines espèces pour prospérer dans des environnements où les températures, la salinité ou l'acidité sont extrêmement élevées, comme les évents thermiques dans l'océan, les sources chaudes et les eaux hypersalines. La stabilité unique du GDGT lui permet également d'être détecté des centaines voire des milliers d'années après la mort de l'organisme. Étant donné que ces organismes ont tendance à produire plus de GDGT à des températures plus élevées, il est considéré comme un candidat prometteur pour estimer la température au cours du temps géologique.
"Pour que GDGT soit utilisé avec précision comme proxy pour reconstruire les changements de températures géologiques, les scientifiques doivent mieux comprendre comment il est fabriqué, quels gènes le codent et quelles espèces peuvent le créer", a déclaré Squire Booker, biochimiste à Penn State. , chercheur au Howard Hughes Medical Institute et chef de l'équipe de recherche. "Mais, jusqu'à présent, il manquait une étape dans la formation de ce lipide. Nous avons utilisé des techniques d'imagerie couplées à des méthodes chimiques et biochimiques pour déconstruire la voie chimique de cette étape manquante."
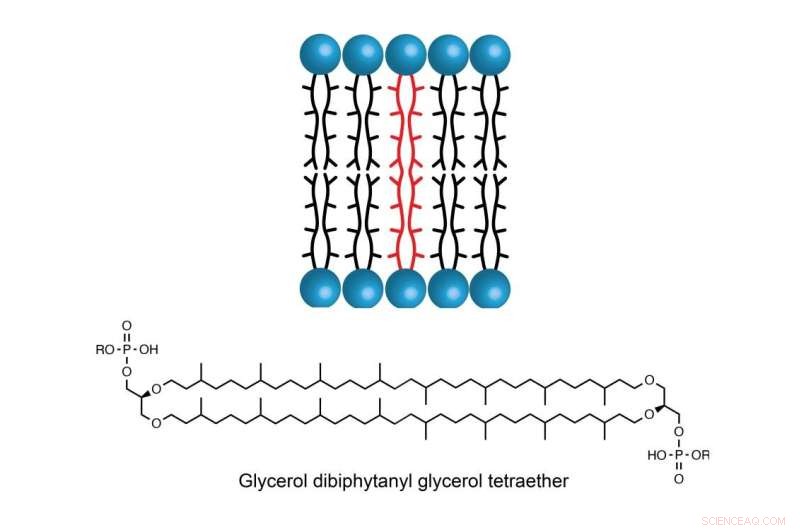
La molécule GDGT se trouve dans la membrane cellulaire de certaines espèces d'archées, permettant aux organismes unicellulaires de prospérer dans des environnements avec des températures, une salinité ou une acidité extrêmement élevées. Crédit :Booker Lab / État de Pennsylvanie
La stabilité de GDGT est en partie due à ses deux longues chaînes d'hydrocarbures qui s'étendent à travers la membrane. Mais la manière dont ces deux chaînes s'enchaînent intrigue les scientifiques depuis des décennies.
"Coupler les carbones à l'extrémité des deux chaînes d'hydrocarbures est un véritable défi pour la chimie car ils sont inertes - ils sont chimiquement inactifs", a déclaré Cody Lloyd, étudiant diplômé à Penn State et membre de l'équipe de recherche. "Nous avons identifié l'enzyme qui active ces carbones terminaux et rend ce couplage possible. De plus, nous connaissons maintenant le gène qui code pour cette enzyme, ce qui devrait améliorer l'utilisation du GDGT comme indicateur des climats passés."
L'enzyme qui facilite le couplage des deux chaînes hydrocarbonées appartient à une classe de protéines appelées protéines SAM radicales, connues pour jouer un rôle important dans diverses réactions chimiques, notamment la production d'antibiotiques, la modification de protéines, d'ADN et ARN, et la création de diverses biomolécules.
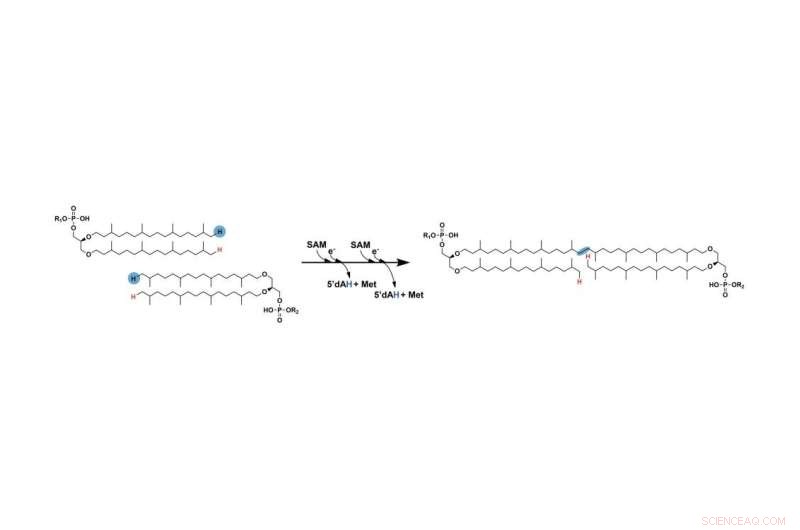
L'étape précédemment manquante dans la formation de GDGT consiste à connecter deux longues chaînes d'hydrocarbures. Les deux hydrogènes marqués en bleu sont finalement supprimés et les chaînes se connectent finalement aux endroits où ces atomes ont été supprimés. Une enzyme SAM radicale facilite ce processus. Crédit :Booker Lab / État de Pennsylvanie
La première étape est similaire à celle d'autres réactions impliquant des enzymes SAM radicales :l'enzyme SAM radicale utilise l'un de ses clusters fer-soufre pour cliver une molécule appelée S-adénosyl-L-méthionine (SAM), produisant un "radical libre" ou un électron non apparié qui est hautement réactif et aide à faire avancer la réaction. Ensuite, le radical arrache un atome d'hydrogène du carbone à la fin de la chaîne. À une étape ultérieure, ce processus se répète avec la deuxième chaîne en utilisant une deuxième molécule de SAM.
"En fin de compte, les carbones à l'extrémité de chacune des chaînes finissent par se lier les uns aux autres à l'endroit où les atomes d'hydrogène ont été éliminés", a déclaré Lloyd. "Mais une fois que l'hydrogène de la première chaîne est retiré, il devient si instable qu'il peut réagir avec à peu près n'importe quoi. Pour empêcher temporairement la première chaîne de réagir avec des cibles non ciblées, le carbone se lie à un atome de soufre d'un autre de les trois amas fer-soufre de l'enzyme."
Une fois que l'hydrogène a été retiré de la deuxième chaîne, le radical résultant encourage la première chaîne à se retirer du groupe fer-soufre sur l'enzyme et à se lier à la place à la deuxième chaîne. Il en résulte que les deux chaînes sont liées ensemble, complétant l'étape manquante dans la formation de GDGT. Les chercheurs présentent leurs résultats dans un article publié en ligne et en version imprimée dans le numéro du 1er septembre de la revue Nature .
"Il s'agit d'une utilisation complètement nouvelle d'un cluster fer-soufre, et c'est le premier exemple dans la nature du couplage de deux atomes de carbone complètement inertes avec cette configuration électronique, que les chimistes appellent hybride sp3", a déclaré Booker. "Il y a eu beaucoup d'intérêt pour la création de ces types de liaisons carbone-carbone à partir de carbones hybrides sp3 dans le cadre de produits pharmaceutiques et d'autres produits industriels. La nature a eu des millions d'années pour comprendre ce genre de choses, alors nous continuons à nous tourner vers la nature. pour s'inspirer de réactions synthétiques - comme cette nouvelle utilisation d'un cluster fer-soufre. La clé de la formation d'un puissant antibiotique est maintenant claire