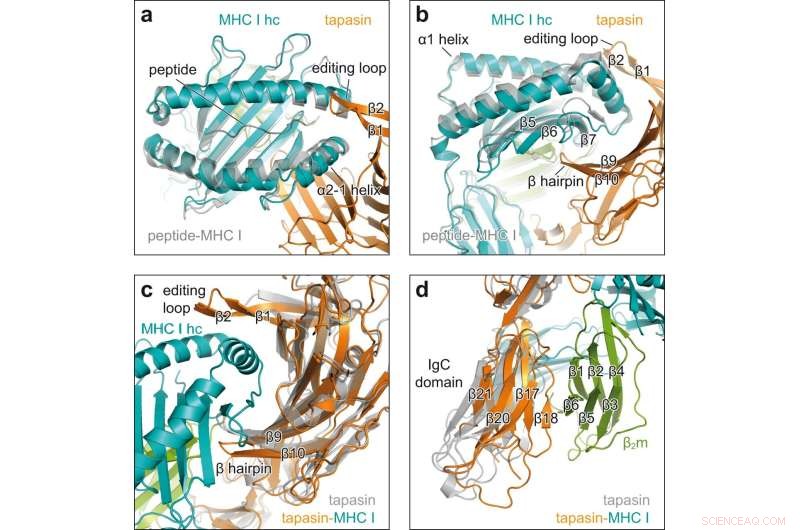
Changements conformationnels lors de l'engagement client-chaperon. a Vue de dessus de la superposition du CMH I réceptif aux peptides dans le complexe chaperon (CMH I hc, sarcelle ; tapasine, orange) avec le H2-D b lié au peptide (gris, PDB ID 2F74) en représentation de bande dessinée. chaîne lourde hc; Brins β1, β2, β de la boucle d'édition de la tapasine. b Vue latérale de la superposition illustrée dans un brins β5, β6, β7, β du CMH I hc ; β9, β10, β épingle à cheveux de tapasin. c Vue sur l'interface concave de la tapasine en superposition de la tapasine liée au CMH I du complexe chaperon (tapasine, orange ; MHC I hc, bleu sarcelle ; β2m, vert) avec la tapasine sans client (gris, PDB ID 3F8U). d Superposition comme en c mais vue sur le domaine C-terminal de la tapasine. domaine constant d'immunoglobuline domaine IgC, β2 m β2 -microglobuline. Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-32841-9
En tant que groupes de travail du système immunitaire adaptatif, les lymphocytes T sont chargés d'attaquer et de tuer les cellules infectées ou cancéreuses. Ces cellules, comme presque toutes les cellules du corps humain, présentent à leur surface des fragments de toutes les protéines qu'elles produisent à l'intérieur. Si ceux-ci comprennent des peptides qu'un lymphocyte T reconnaît comme étrangers, le lymphocyte est activé et tue la cellule en question.
Il est donc important pour une réponse robuste des lymphocytes T que des fragments de protéines appropriés soient présentés au lymphocyte T. L'équipe de recherche dirigée par Simon Trowitzsch et Robert Tampé de l'Institut de biochimie de l'Université Goethe de Francfort a maintenant mis en lumière la manière dont la cellule sélectionne ces fragments de protéines ou peptides.
La présentation peptidique a lieu sur des molécules dites de classe I du complexe majeur d'histocompatibilité (MHC I). Les molécules du CMH I sont un groupe de protéines de surface très diverses qui peuvent lier des myriades de peptides différents. Ils sont ancrés dans la membrane cellulaire et forment une poche de liaison peptidique avec leur partie tournée vers l'extérieur.
Comme toutes les protéines de surface, les molécules du CMH I empruntent la voie dite de sécrétion :elles sont synthétisées dans le système de la cavité cellulaire (réticulum endoplasmique (RE) et appareil de Golgi) et y sont repliées. De petites vésicules bourgeonnent alors du système de la cavité, migrent vers la membrane cellulaire et fusionnent avec elle.
Le processus de maturation des molécules du CMH I est très strictement contrôlé :dans le RE, des protéines appelées « chaperons » les aident à se replier. La tapasine chaperonne est essentielle pour le chargement des peptides dans ce processus.
"Lorsqu'une molécule du CMH I s'est liée à un peptide, la tapasine vérifie à quel point la liaison est étroite", explique Trowitzsch, expliquant la tâche du chaperon. "Si la liaison est instable, le peptide est retiré et remplacé par un autre qui se lie étroitement." Cependant, il n'a pas encore été possible de clarifier exactement comment tapasin exécute cette tâche, en particulier parce que le processus de chargement est extrêmement rapide.
Les biochimistes et les biologistes structurels de l'Université Goethe de Francfort ont maintenant réussi pour la première fois à visualiser l'interaction de courte durée entre la chaperonne et la molécule du CMH I au moyen d'une analyse de structure aux rayons X.
Pour ce faire, ils ont produit des variants des deux partenaires d'interaction qui n'étaient plus intégrés dans la membrane, les ont purifiés et les ont réunis. Une astuce a permis de capturer le complexe de chargement en action pour la cristallisation :tout d'abord, l'équipe de recherche a chargé la molécule du CMH I avec un peptide de haute affinité afin de créer un complexe stable.
Un signal lumineux a déclenché le clivage du peptide, ce qui a fortement réduit sa capacité à se lier à la molécule MHC I. Immédiatement, la tapasine est entrée en scène et est restée liée à la molécule du CMH I dépourvue de son peptide. "Le clivage photo-induit du peptide a été essentiel au succès de notre expérience", explique Tampé. "Avec l'aide de cette biologie optochimique, nous pouvons désormais reproduire systématiquement un par un des processus cellulaires complexes."
L'analyse de la structure aux rayons X des cristaux a révélé comment la tapasine élargit la poche de liaison peptidique de la molécule MHC I, testant ainsi la force de la liaison peptidique. A cet effet, les partenaires d'interaction forment une large zone de contact; pour la stabilisation, une boucle de tapasin se trouve au-dessus de la poche de reliure élargie.
"C'est la première fois que nous montrons le processus de chargement à haute résolution", déclare Tampé. Les images révèlent également comment un seul chaperon peut interagir avec l'énorme diversité des molécules du CMH I, explique le biochimiste. "La tapasine lie précisément les régions non variables des molécules du CMH I." Cependant, la nouvelle structure améliore non seulement notre compréhension des processus complexes impliqués dans le chargement des molécules du CMH I. Cela devrait également aider à sélectionner des candidats appropriés pour le développement de vaccins.
La recherche a été publiée dans Nature Communications . Signalisation routière pour les cellules de défense immunitaire