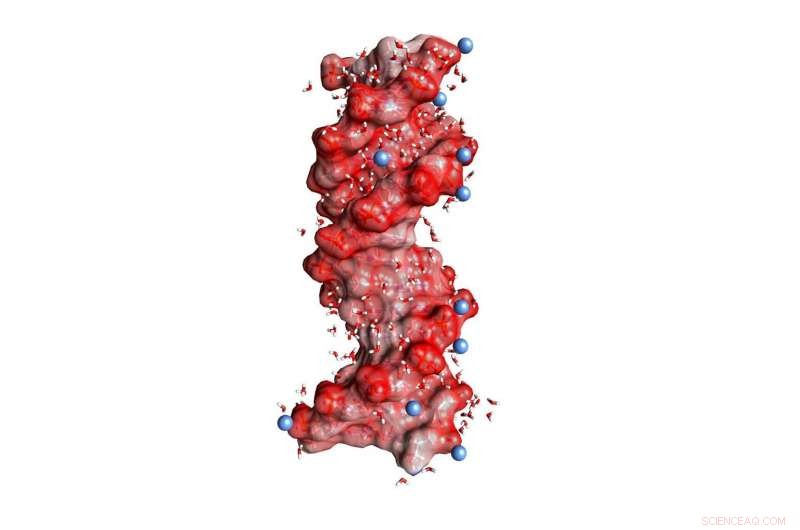
Fig. 1 :double hélice d'ADN noyée dans l'eau (petites molécules coudées, Pas à l'échelle). Les sphères rouge foncé sur la surface de l'hélice représentent les atomes d'oxygène des unités PO2 chargées négativement, les sphères bleues chargées positivement des ions dans l'environnement. Crédit :MBI Berlin
Des paires de groupes phosphates chargés négativement et d'ions magnésium positifs représentent une caractéristique structurelle clé de l'ADN et de l'ARN noyés dans l'eau. Les vibrations des groupes phosphate ont maintenant été établies en tant que sondes sélectives de telles paires de contact et permettent une cartographie des interactions et de la structure sur les échelles de temps ultrarapides de la dynamique moléculaire.
L'ADN et l'ARN sont des polymères chargés qui codent l'information génétique dans une structure en double hélice et jouent un rôle clé dans la biosynthèse des protéines. Leurs charges négatives sont situées dans le squelette moléculaire, qui se compose de phosphate ionique (PO 2- ) et des groupes sucres (Figure 1). La stabilisation des structures macromoléculaires de l'ADN et de l'ARN nécessite une compensation des forces électriques répulsives fortes entre les groupes phosphate également chargés par des ions de contraire, c'est à dire., charge positive. Dans ce contexte, magnésium (Mg 2+ ) sont particulièrement pertinents car ils stabilisent non seulement la structure, mais interviennent également dans la reconnaissance de partenaires de liaison externes et agissent comme des centres catalytiques. De plus, les changements de structure macromoléculaire via des processus de repliement dynamique sont liés à un réarrangement des ions positifs noyés dans la coquille d'eau environnante.
Les ions positifs sont disposés dans différentes géométries autour de l'ADN et de l'ARN :dans des géométries dites liées au site ou à paires de contact, un ion positif est situé en contact direct avec un atome d'oxygène d'un groupe phosphate. En revanche, l'atmosphère dite externe d'ions est constituée d'ions positifs séparés par au moins une couche de molécules d'eau des groupes phosphate. Le rôle fonctionnel des différentes géométries et les interactions sous-jacentes sont loin d'être compris. Une compréhension plus approfondie au niveau moléculaire nécessite des sondes très sensibles qui permettent de discerner les différentes géométries d'ions sans les perturber, et pour cartographier leur dynamique sur l'échelle de temps ultrarapide des mouvements moléculaires.

Fig. 2 :En haut :Structure moléculaire d'une paire d'ions de contact constituée de diméthylphosphate (DMP) et d'un ion magnésium Mg2 noyé dans l'eau. Les flèches marquent les allongements des liaisons phosphore-oxygène dans la vibration d'étirement asymétrique de PO2. En bas :Spectres infrarouges bidimensionnels (2D-IR) de la vibration d'étirement asymétrique de PO2 mesurés à un temps d'attente T=500 fs après excitation vibrationnelle. La réponse vibrationnelle est représentée en fonction de l'excitation infrarouge et des fréquences de détection et consiste en une composante P1 des molécules de DMP sans ion magnésium dans le voisinage et la contribution P2 des paires d'ions de contact. Ce dernier est décalé vers des fréquences plus élevées en raison de l'interaction entre PO2- et Mg2 . Crédit :MBI Berlin
Dans une publication récente, des chercheurs du Max Born Institute (MBI) démontrent que les vibrations des groupes phosphates représentent des sondes sensibles et non invasives des géométries ioniques dans un environnement aquatique. Diméthylphosphate (DMP, (CH 3 O)2PO 2- ), un système modèle établi pour le squelette d'ADN et d'ARN, a été préparé dans de l'eau liquide avec un excès de Mg 2+ ions (figure 2, haut) et étudiée par spectroscopie vibrationnelle non linéaire dans le domaine temporel femtoseconde (1 fs =10 -15 s). Les expériences utilisent la spectroscopie infrarouge bidimensionnelle (2-D-IR), une méthode des plus sophistiquées pour analyser les interactions et les structures ioniques sur l'échelle de temps intrinsèque des mouvements moléculaires fluctuants.
La carte des expériences Mg 2+ ions en contact direct avec un PO 2- groupe via une caractéristique distincte dans le spectre 2-D-IR (Figure 2, bas). L'interaction avec le Mg 2+ l'ion décale le PO asymétrique 2- étirer la vibration à une fréquence plus élevée qu'en l'absence de Mg 2+ ions. La forme de la ligne et l'évolution temporelle de cette nouvelle fonctionnalité révèlent des fluctuations de la géométrie de la paire d'ions de contact et de la couche d'eau enrobée sur une échelle de temps de plusieurs centaines de femtosecondes alors que la paire de contact elle-même existe pendant des temps beaucoup plus longs (~10 -6 s). Une analyse théorique approfondie montre que l'équilibre subtil des forces électrostatiques attractives (Coulomb) et des forces répulsives dues à l'interaction d'échange quantique-mécanique régit la position fréquentielle de la vibration du phosphate.
La capacité de la spectroscopie 2-D-IR à caractériser l'interaction phosphate-ion à courte distance en solution fournit un nouvel outil analytique qui complète les techniques structurelles actuellement disponibles. Une extension de cette nouvelle approche à l'ADN et à l'ARN et à leur environnement ionique est très prometteuse et devrait fournir de nouvelles informations sur les forces stabilisant les structures d'équilibre et entraînant les processus de repliement.