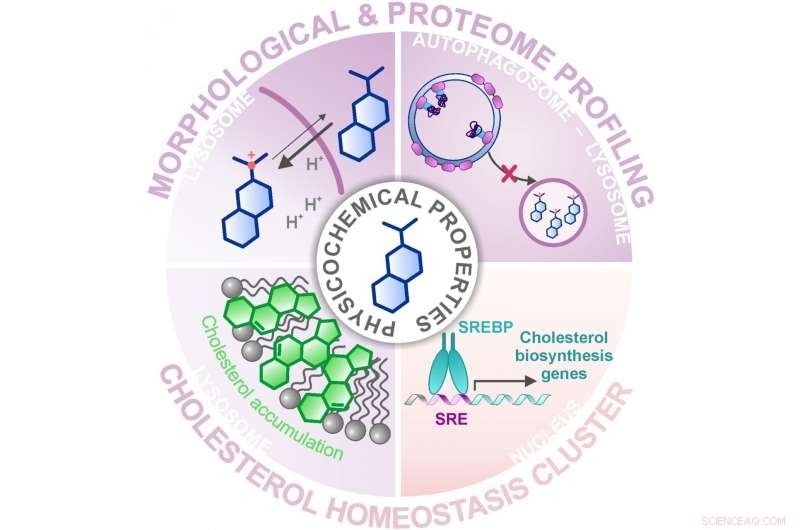
Application du profilage morphologique et protéomique, un groupe de substances déjà caractérisées a été identifié qui module l'homéostasie du cholestérol. Crédit :MPI de Physiologie Moléculaire
Lorsqu'Alexander Flemming a découvert une moisissure sur une plaque de culture envahie par des bactéries en 1928, il ne s'attendait pas à trouver l'une des substances actives les plus utilisées :la pénicilline. Découvertes accidentelles et identification de principes actifs issus de remèdes traditionnels, comme la morphine du pavot à opium, ont longtemps façonné la découverte de nouveaux médicaments.
La découverte de médicaments modernes :du hasard au système
Pendant ce temps, des développements majeurs en chimie et en biologie moléculaire ont été réalisés qui permettent une recherche systématique et ciblée de substances actives potentielles dans la découverte de médicaments modernes. D'abord, les avancées dans le domaine de la chimie organique et surtout combinatoire ont permis de produire d'énormes bibliothèques de substances et de tester leur effet pharmacologique dans des tests à haut débit. Les avancées technologiques telles que le séquençage du génome humain et le développement de nouvelles méthodes en biologie moléculaire ont permis d'identifier les processus cellulaires liés aux maladies et leurs acteurs moléculaires clés. Cela a ouvert la voie à la découverte de médicaments modernes, où de grandes bibliothèques de molécules sont criblées à haut débit pour leur influence sur les molécules cibles pertinentes, principalement des protéines. Substances identifiées, soi-disant coups, sont optimisés dans leur structure chimique pour conduire à des structures déjà efficaces à faible dose et bien absorbées et réparties dans l'organisme.
Aucun effet sans effets secondaires
Ce développement de médicaments ciblés est très efficace pour identifier de nouveaux candidats médicaments qui empêchent les protéines cibles de fonctionner ou d'interagir avec d'autres protéines. Cependant, Les candidats-médicaments potentiels sont rarement spécifiques et agissent très souvent également sur des protéines apparentées qui ont une fonction ou une structure similaire. « Il n'est pas rare qu'un candidat médicament initialement prometteur présente de manière inattendue des effets secondaires graves dans une phase ultérieure de son développement de longue date, limitant voire empêchant son utilisation clinique, " dit Slava Ziegler.
A la recherche de bioactivités inconnues
Afin de détecter les effets secondaires possibles lors du développement du médicament, les candidats-médicaments potentiels sont criblés dans des essais pour leur effet sur les classes de protéines connues, processus biologiques et certaines propriétés cellulaires. Cependant, ces tests ne peuvent que refléter la bioactivité attendue car le nombre de molécules cibles connues dans la cellule est limité. Les approches dites de profilage offrent désormais la possibilité de détecter un spectre d'activité plus large. Ces tests impartiaux étudient l'influence sur des centaines de paramètres cellulaires ou génétiques enregistrés dans le profil d'une substance qui est comparé aux profils de substances de référence ayant des effets connus.
Lorsque les profils de médicaments correspondent
Dans leur dernière étude, le groupe d'Herbert Waldmann et Slava Ziegler a combiné deux de ces approches de profilage pour identifier des substances bioactives à partir d'une bibliothèque d'environ 15 000 molécules inspirées de produits naturels et les a comparées aux profils de substances connues, composés actifs. Application du test de peinture cellulaire, où les zones fonctionnelles de la cellule sont colorées puis examinées au microscope pour les changements, un grand groupe de substances avec des profils similaires a été identifié. Cependant, il n'a pas été possible de prédire le mode d'action du cluster car les composés de référence associés avaient diverses activités ou molécules cibles. Avec une recherche ultérieure utilisant le profilage du protéome, dans lequel les quantités et donc la régulation de milliers de protéines ont été examinées, les chercheurs ont pu réduire le groupe à une activité commune - la modulation de l'homéostasie du cholestérol - une activité biologique inattendue pour la plupart des substances de référence du groupe.
Deux oiseaux avec une pierre :identifier de nouvelles bioactivités et effets secondaires
Mais comment des substances avec des molécules cibles très différentes peuvent-elles déclencher le même effet ? Les chercheurs ont révélé que la plupart des composés du cluster s'accumulent dans le lysosome, un organite où le cholestérol est stocké temporairement pour sa fonction ultérieure dans la cellule. Le lysosome a un pH plus faible que le reste de la cellule, et ceci est crucial pour le fonctionnement des enzymes digestives lysosomales qui traitent les biomolécules étrangères et les propres biomolécules de la cellule. Dans le lysosome, les substances du cluster décrit augmentent la valeur du pH et perturbent ainsi la fonction de cet organite et, en particulier, l'équilibre du cholestérol de la cellule. Le fait que les composés s'accumulent dans le lysosome n'est pas dû à une molécule cible spécifique dans le lysosome mais à leurs propriétés chimiques et physiques, qu'ils ont obtenus grâce à leur optimisation structurelle pour une meilleure solubilité.
"De façon intéressante, l'équilibre du cholestérol perturbé a déjà été lié à certains médicaments sur le marché, comme les antipsychotiques", note Tabea Schneidewind, premier auteur de l'étude. " Avec la combinaison des deux stratégies de recherche, nous pouvons faire d'une pierre deux coups :dévoiler des effets secondaires inconnus et identifier de nouvelles substances actives et modes d'action », explique Slava Ziegler.
Cibler l'homéostasie du cholestérol pourrait également perturber les infections au SRAS-CoV-2
L'influence de l'homéostasie du cholestérol semble être une caractéristique commune à de nombreux composés et doit être prise en compte lors de l'évaluation des effets secondaires des substances actives. Cependant, l'activité observée n'est pas en soi indésirable. Actuellement, les médicaments et les composés aux modes d'action connus sont intensivement étudiés pour l'inhibition de l'infection par le SRAS-CoV-2 des cellules hôtes, et de nombreux composés de notre cluster ont été identifiés pour supprimer ce processus. De façon intéressante, le cholestérol membranaire et donc une bonne homéostasie du cholestérol sont cruciaux pour l'infection par Sars-CoV-2, comme le montrent plusieurs études. Nos données expliquent très probablement la raison de l'activité de ces composés contre le virus :ils altèrent la biosynthèse et la localisation du cholestérol dans les cellules, qui altère l'infection à Corona-Virus", dit Slava Ziegler.