Crédit :Wiley
Les réactions chimiques ne se déroulent pas toujours comme prévu. Les sous-produits indésirables entraînent des coûts supplémentaires et des déchets de ressources. Les catalyseurs sélectifs peuvent aider, mais les chimistes doivent tester un grand nombre avant de trouver la bonne solution. Les chercheurs ont maintenant enquêté, au niveau atomique, comment obtenir un catalyseur au palladium pour l'hydrogénation sélective de l'acroléine. La clé semble être un dense, couche convertible de molécules de ligand, rapporter les auteurs dans la revue Angewandte Chemie .
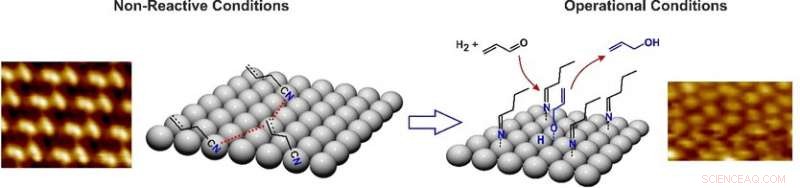
La molécule d'acroléine a deux positions où elle peut être hydrogénée. Lorsqu'il réagit avec de l'hydrogène, soit l'alcool, propénol, ou l'aldéhyde, propane, est formé. Des catalyseurs au palladium peuvent être utilisés pour orienter la réaction vers le propénol, mais les scientifiques ont observé que cela ne fonctionne que si la surface du métal a déjà été recouverte du partenaire de réaction ou d'un hydrocarbure similaire en tant que précurseur de ligand. Swetlana Schauermann et son équipe à l'Université de Kiel, Allemagne, ont maintenant étudié pourquoi c'est le cas et ce qui se passe réellement dans cette réaction.
Pour les expériences de l'équipe, ils ont d'abord enduit du palladium métallique pur avec du cyanure d'allyle, le précurseur de ligand pour la réaction. Pour visualiser ce revêtement en détail, les chercheurs ont analysé la surface du palladium en utilisant la microscopie à effet tunnel. Les résultats ont montré un revêtement "plat" du cyanure d'allyle où les trois atomes de carbone de l'allyle, ainsi que la fonction cyanure, reposer à plat sur les atomes de métal. Aucune saillie de la surface n'a été notée.
Cette couche plate de ligand a changé lorsque le métal a été exposé aux conditions de réaction et un courant d'hydrogène a été passé sur la surface du métal. La microscopie à effet tunnel a révélé un revêtement dense, mais avec des distances considérablement plus courtes entre les molécules. Les chercheurs ont utilisé le type de changements en cours, et analyses spectroscopiques, pour comprendre exactement ce qui se passait. L'hydrogène avait hydrogéné la molécule de cyanure d'allyle et l'avait convertie en un hydrocarbure saturé avec un groupe fonctionnel imine.
L'imine n'était pourtant plus à plat sur la surface :il était debout. Cela s'est produit parce que la fin de la molécule avec le résidu d'hydrocarbure saturé avait perdu le contact avec les atomes de palladium, tandis que la fonction imine restait liée au métal. La surface plane du catalyseur s'était transformée en une forêt d'arbres moléculaires dressés.
Ce nouveau revêtement a activé le catalyseur, permettant un amarrage positionnel précis de l'acroléine et l'activation de la fonction oxygène prête pour l'hydrogénation. "Sur cette couche active, l'acroléine forme presque instantanément l'intermédiaire de réaction propénoxy souhaité suivi du dégagement du propénol produit cible, " observent les auteurs.
La chimiosélectivité et l'activité du catalyseur au palladium pourraient être expliquées en détail. "C'est la première preuve expérimentale de la formation d'une couche de ligand actif obtenue par microscopie spatiale réelle, " déclarent les auteurs. L'équipe espère que cette nouvelle, une compréhension plus approfondie pourrait être utilisée pour trouver d'autres fonctionnalisations pour améliorer la chimiosélectivité des catalyseurs métalliques.