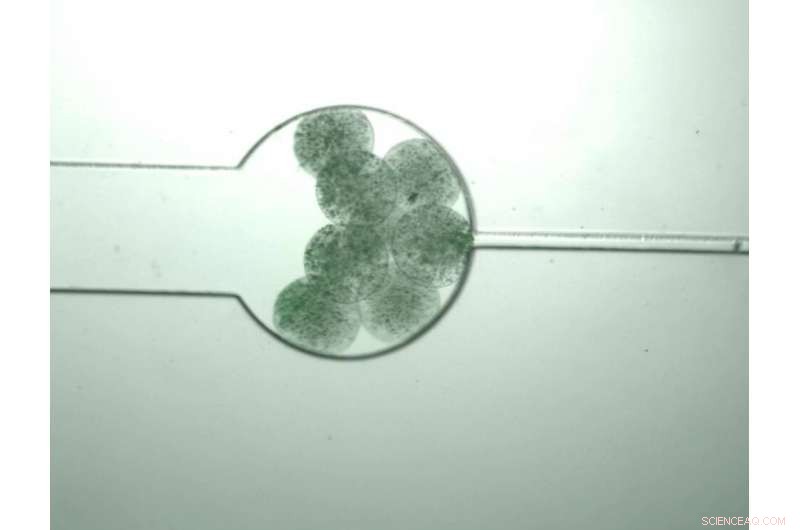
'Swarmbots, ' des cellules vivantes conçues pour produire des molécules monomères, croître jusqu'à ce qu'ils sentent que leur densité de population a atteint un certain niveau, sur quoi ils s'ouvrirent, permettant aux monomères de se mélanger et de s'auto-assembler en un polymère composite. Crédit :Zhuojun Dai
Les ingénieurs biomédicaux de l'Université Duke ont démontré qu'une classe de matériaux composites entrelacés appelés réseaux polymères semi-interpénétrés (sIPN) peut être produit par des cellules vivantes. L'approche pourrait rendre ces matériaux polyvalents plus biologiquement compatibles pour des applications biomédicales telles que les systèmes d'administration de médicaments à retardement.
La recherche paraît en ligne le 8 juin dans la revue Communication Nature .
Le concept de sIPN existe depuis plus de 100 ans et a été utilisé dans les pièces automobiles, Équipement médical, composés de moulage et plastiques techniques. L'idée générale est qu'un ou plusieurs polymères s'assemblent autour d'un autre échafaudage polymère de telle manière qu'ils s'emboîtent. Même si les polymères ne sont pas liés chimiquement, ils ne peuvent pas être séparés et forment un nouveau matériau avec des propriétés supérieures à la simple somme de ses parties.
Les méthodes traditionnelles de fabrication des sIPN impliquent généralement la production des éléments constitutifs appelés monomères et leur mélange dans les bonnes conditions chimiques pour contrôler leur assemblage en grands réseaux dans un processus appelé polymérisation.
"Quand ça marche, c'est une plate-forme fantastique qui peut incorporer différentes fonctionnalités dans la couche auto-assemblée pour des applications biomédicales ou environnementales, " dit Lingchong You, professeur de génie biomédical à Duke. « Mais le processus n'est souvent pas aussi biocompatible que vous pourriez le souhaiter. Nous avons donc pensé pourquoi ne pas utiliser des cellules vivantes pour synthétiser la deuxième couche afin de la rendre aussi biocompatible que possible ? »
Dans le nouveau journal, Zhuojun Dai, un ancien post-doctorant du laboratoire You, aujourd'hui professeur agrégé au Shenzhen Institute of Synthetic Biology, utilise pour cela une plate-forme que le laboratoire développe depuis plusieurs années, appelée « swarmbots ».
Les swarmbots sont des cellules vivantes qui sont programmées pour produire des molécules biologiques à l'intérieur de leurs murs puis exploser une fois que leur population atteint une certaine densité. Dans ce cas, ils sont programmés pour produire des monomères appelés polypeptides de type élastine (ELP) fusionnés à des caractéristiques fonctionnelles appelées SpyTag et SpyCatcher. Ces deux structures moléculaires forment un système de verrouillage et de clé, permettant aux PEL de s'auto-assembler en une chaîne polymère lorsqu'ils sont mélangés. Au fur et à mesure qu'ils grandissent, ces polymères s'entremêlent avec les microcapsules polymères contenant les cellules pour former des sIPN.
Chaque monomère peut contenir plusieurs SpyTags ou SpyCatchers et peut également être fusionné à des protéines qui génèrent une lecture ou ont des fonctions spécifiques. C'est un peu comme faire une clôture à mailles losangées à partir de nombreux petits bracelets à breloques qui ont de la place pour des fermoirs et des breloques.
Les chercheurs programment d'abord les cellules pour remplir cette caractéristique accessoirisable avec une protéine fluorescente pour prouver que le système peut les verrouiller en place. Après cette démonstration réussie, ils tournent leur attention vers la conception d'un système d'administration de médicaments utile avec leur nouvelle invention.
« Vous pouvez remplacer le marqueur fluorescent par tout ce qui a une fonction que vous souhaitez présenter, " a dit You. " Nous avons décidé d'aborder les antibiotiques parce que c'est l'un des autres axes de notre laboratoire. "
Antibiotiques bêta-lactamines, comme la pénicilline et ses dérivés, sont parmi les antibiotiques les plus couramment utilisés dans le monde. Ils sont également souvent surutilisés et peuvent avoir des effets négatifs tels que la destruction du microbiome naturel qui vit dans nos intestins.
Pour démontrer une manière dont leurs nouveaux sIPN construits sur des cellules pourraient être utiles, les chercheurs remplissent le spot accessoirisable de bêta-lactamase, qui peuvent dégrader les antibiotiques bêta-lactamines. En injectant les sIPN nouvellement fonctionnalisés à des souris, les chercheurs ont montré que la plate-forme pouvait libérer lentement la molécule protectrice autrement de courte durée pour aider les microbiomes intestinaux des souris à éviter les effets secondaires négatifs des antibiotiques.
"Personne n'a utilisé des cellules vivantes comme usine pour produire des monomères en temps réel pour les sIPN auparavant, " a dit You. " La démonstration de la preuve de principe montre que, non seulement pouvons-nous fabriquer ces types de matériaux fonctionnels avec des cellules vivantes, mais ils peuvent présenter des fonctions médicalement pertinentes."