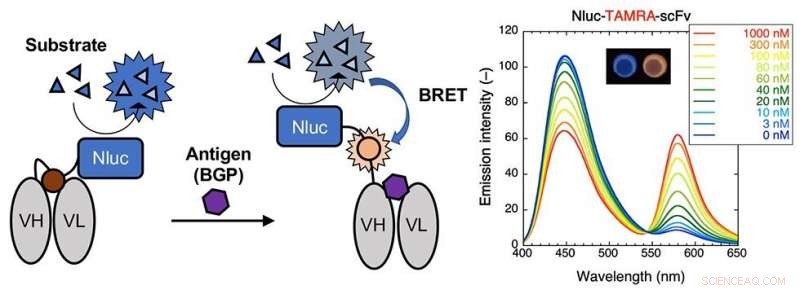
L'enzyme "Nluc" est ajoutée au Q-body formant un Bret Q-body. La luminescence est observée lors de la liaison à l'antigène. À droite, des spectres d'émission en présence du substrat du corps BRET-Q marqué avec le colorant fluorescent TAMRA-C5-mal peuvent être observés. L'encart montre le changement de couleur observé lors de la liaison à l'antigène. Crédit : Tokyo Tech
Les immunocapteurs sont largement utilisés dans les dosages immunologiques pour détecter les antigènes. Un de ces immunocapteurs est un quenchbody (Q-body), qui contient un fragment d'anticorps modifié avec un colorant fluorescent désactivé. Lorsqu'un antigène se lie au corps Q, le colorant quitte l'anticorps et la fluorescence s'intensifie. Le changement d'intensité de fluorescence est facile à mesurer, rendant les systèmes de détection d'antigènes basés sur Q-body incroyablement simples. Cependant, cette méthode nécessite une source de lumière externe pour exciter les électrons dans le colorant fluorescent afin de produire une luminescence.
Une façon de résoudre ce problème est d'induire une luminescence par une méthode alternative. Pour y parvenir, chercheurs de Tokyo Tech, Japon, ont développé un nouvel immunocapteur. Ils ont utilisé une enzyme luciférase modifiée appelée "NanoLuc" (Nluc) qui est à l'origine responsable de la bioluminescence chez les crevettes et l'a fusionnée au corps Q. Cet immunocapteur, appelé "BRET Q-body, " fonctionne sur le principe du transfert d'énergie par résonance de bioluminescence (BRET). Ici, un substrat luminescent est ajouté au corps Q fusionné. Le substrat réagit avec l'enzyme et cette réaction fournit l'énergie requise par le colorant pour induire la fluorescence. Ce type de luminescence est avantageux, comme le professeur Hiroshi Ueda, qui dirige l'équipe de chercheurs, explique:"Le système BRET Q-body peut être utilisé pour visualiser la présence ou l'absence d'un antigène comme un changement de la couleur d'émission sans aucun instrument." Leurs résultats ont été récemment publiés dans la revue Chimie analytique .
Pour préparer le BRET Q-body, les chercheurs ont utilisé un fragment d'anticorps monocaténaire qui se lie à l'antigène BGP, une protéine présente dans l'os. Le fragment d'anticorps a ensuite été marqué avec un colorant fluorescent. Ils ont ensuite testé l'intensité de fluorescence des corps BRET Q résultants et ont observé que l'ajout de l'antigène augmentait l'intensité de la fluorescence.
Après ces premiers résultats, les chercheurs ont testé la dépendance antigénique du BRET Q-body. Ils ont comparé la fluorescence obtenue par la nouvelle méthode basée sur le BRET à la méthode conventionnelle basée sur l'irradiation. L'intensité de fluorescence du corps BRET-Q a été initialement mesurée avec une lumière d'excitation et plus tard en présence du substrat luminescent. Ils ont découvert que la liaison à l'antigène rapprochait l'enzyme Nluc et le colorant, entraînant des niveaux d'intensité de fluorescence plus élevés lorsque le substrat était utilisé. Comme la luminescence du corps BRET Q est obtenue initialement à partir de l'enzyme puis du colorant fluorescent lors de la liaison à l'antigène, un simple changement de couleur indique la présence d'un antigène.
Cette étude ouvre la voie à une nouvelle classe de capteurs bioluminescents qui ne nécessitent pas de source lumineuse d'excitation externe. Les nouveaux BRET Q-bodies devraient rendre les tests immunologiques beaucoup plus simples et plus précis. Comme le professeur Ueda explique les avantages et les applications potentielles de leurs découvertes, "La détection du signal BRET ne nécessite pas de source lumineuse, permet l'observation visuelle du changement de couleur, et une intégration plus facile à un appareil basé sur un smartphone. Par conséquent, nous nous attendons à ce que les BRET Q-bodies soient un outil prometteur pour le diagnostic, la sécurité alimentaire, préservation de l'environnement, et la recherche biologique.