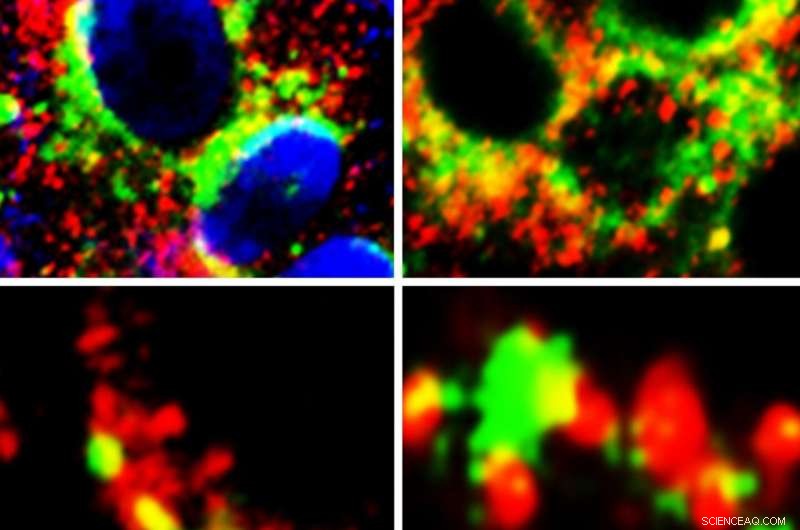
Cellules montrant la proximité (jaune) de GRP78 (vert) avec la protéine Spike de SARS-Cov-2 (rouge) (panneaux de gauche) et ACE2 (rouge) (panneaux de droite). Crédit :Auteur principal Anthony Carlos, Doctorat
Le développement rapide de vaccins a fourni un outil essentiel pour lutter contre la propagation du virus mortel du SRAS-CoV-2, mais les défis pour atteindre l'immunité collective posés par l'augmentation de nouvelles mutations et l'incapacité des personnes immunodéprimées à développer une réponse immunitaire efficace après la vaccination indiquent un besoin de solutions supplémentaires pour maximiser la protection.
Une nouvelle étude de l'USC publiée dans le Journal de chimie biologique révèle comment les thérapies ciblant un chaperon moléculaire appelé GRP78 pourraient offrir une protection supplémentaire contre le COVID-19 et d'autres coronavirus qui émergent à l'avenir.
Les chaperons comme GRP78 sont des molécules qui aident à réguler le bon repliement des protéines, surtout quand une cellule est sous tension. Mais dans certains cas, les virus peuvent détourner ces chaperons pour infecter les cellules cibles, où ils se reproduisent et se propagent. GRP78 a été impliqué dans la propagation d'autres virus graves, comme Ebola et Zika.
GRP78 joue plus d'un rôle dans COVID-19
Alors que des études ont montré que le SRAS-CoV-2, le virus qui cause le COVID-19, infecte les cellules en se liant aux récepteurs ACE2 à leur surface, des chercheurs de la Keck School of Medicine de l'USC ont examiné si le GRP78 avait également un rôle à jouer.
Ils ont découvert que le GRP78 sert de corécepteur et d'agent stabilisant entre l'ACE2 et le SARS-CoV-2, améliorant la reconnaissance de la protéine de pointe du virus et permettant une entrée virale plus efficace dans les cellules hôtes.
Cette étude fournit la première preuve expérimentale à l'appui des prédictions de modélisation informatique, démontrant que GRP78 se lie à la protéine Spike du SRAS-CoV-2 dans les cellules. De façon intéressante, la modélisation informatique montre en outre que les variantes de COVID-19 qui sont plus infectieuses se lient plus fortement au GRP78.
En outre, l'équipe de recherche a découvert que le GRP78 se lie également à et agit comme un régulateur de l'ACE2 - amenant la protéine à la surface cellulaire, qui offre au SARS-CoV-2 plus de points pour se lier aux cellules et les infecter.
« Notre étude révèle que la thérapie ciblant le GRP78 pourrait être plus efficace pour protéger et traiter les personnes qui contractent le COVID-19 que les vaccins seuls, en particulier en ce qui concerne les personnes qui ne peuvent pas obtenir le vaccin et les variantes qui pourraient contourner la protection vaccinale mais dépendent toujours du GRP78 pour l'entrée et la production, " a déclaré l'auteur principal Amy S. Lee, Doctorat., Judy et Larry Freeman Chaire de recherche scientifique fondamentale et professeur au département de biochimie et de médecine moléculaire de la Keck School of Medicine de l'USC.
Comment le SARS-CoV-2 détourne GRP78
Le travail du GRP78 en tant que molécule chaperon consiste à replier les protéines dans le réticulum endoplasmique (RE), qui est une usine de production de protéines. En cas de stress, y compris le stress causé par l'infection par le SRAS-CoV-2, Le GRP78 est expédié à la surface de la cellule. Là, il facilite la liaison entre l'ACE2 et la protéine Spike du SARS-CoV-2, conduisant à une entrée virale améliorée. Une fois à l'intérieur de la cellule, les virus sont connus pour détourner la machinerie de repliement des protéines du RE, dont GRP78 est un acteur clé, pour produire plus de protéines virales.
Ce processus peut être intensifié dans les cellules soumises au stress d'autres maladies comme le diabète ou le cancer, ce qui peut être l'une des raisons pour lesquelles les personnes souffrant de problèmes de santé sous-jacents sont plus sensibles à l'infection par le SRAS-CoV-2.
Pour étudier le rôle du GRP78 dans l'infection par le SRAS-CoV-2, les chercheurs ont traité des cellules épithéliales pulmonaires avec un anticorps monoclonal humanisé (hMAb159), connu pour éliminer le GRP78 de la surface cellulaire sans effets indésirables dans les modèles murins. L'intervention a supprimé le GRP78 et réduit l'ACE2 à la surface cellulaire, diminuant le nombre de cibles auxquelles le SARS-CoV-2 pourrait s'attacher.
Ces résultats ont amené les chercheurs à conclure que les interventions, tels que hMAb159, pour éliminer la surface cellulaire, le GRP78 pourrait réduire l'infection par le SRAS-CoV-2 et inhiber la propagation et la gravité du COVID-19 chez les personnes infectées.
Potentiel de traitement ciblé GRP78
Les cellules saines ont besoin d'une fraction de GRP78 pour fonctionner normalement. Cependant, cellules stressées, telles que les cellules infectées par un virus ou cancéreuses, besoin de plus de GRP78 pour survivre et se multiplier, Ainsi, les traitements qui réduisent la quantité de GRP78 dans le corps pourraient réduire la gravité de l'infection par le SRAS-CoV-2 et se propager sans effets indésirables.
Alors que cette étude a utilisé un anticorps monoclonal, les chercheurs disent qu'il existe d'autres agents qui pourraient être utilisés pour réduire la quantité ou l'activité du GRP78, créer de multiples voies pour des solutions médicamenteuses potentielles pour cibler le GRP78.
"Ce qui est particulièrement excitant pour cette découverte, c'est que le GRP78 pourrait être une cible universelle en combinaison avec les thérapies existantes non seulement pour lutter contre le COVID-19, mais d'autres virus mortels qui dépendent également du GRP78 pour leur infectiosité, " dit Lee.
La prochaine étape pour l'équipe de recherche consiste à approfondir ces résultats grâce à des études animales.