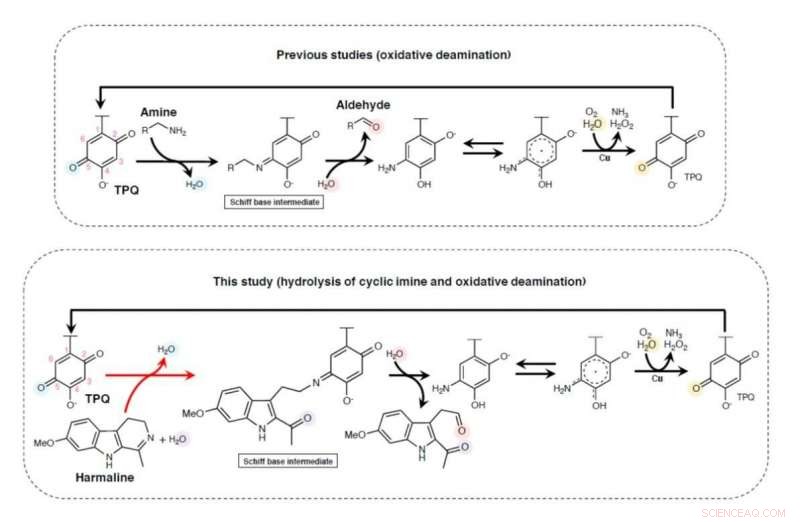
Diagramme schématique d'un mécanisme de réaction possible des réactions catalysées par HarA. Crédit :Université de Tsukuba
Les imines cycliques forment une classe générale de composés chimiques qui comprend les métabolites de médicaments utilisés pour traiter une grande variété de conditions. Les alcaloïdes -carbolines en particulier ont été largement étudiés en tant que médicaments, montrant d'excellentes bioactivités, et ont été utilisés dans le traitement de l'hypertension. Cependant, malgré une bonne compréhension de la biosynthèse qui forme les imines cycliques, la dégradation de ces composés n'est pas bien comprise. Maintenant, des chercheurs de l'Université de Tsukuba ont isolé des micro-organismes cycliques métabolisant les imines du sol, identifié une enzyme métabolisant l'imine cyclique, et a proposé son mécanisme catalytique. Leurs conclusions sont publiées dans Communication Nature .
L'harmaline est l'un des alcaloïdes -carbolines les plus simples, qui est un composant bioactif de la plante médicinale Peganum harmala. Les racines, des graines, les feuilles et l'écorce de P. harmala ont été utilisées en médecine traditionnelle dans diverses cultures à travers le monde. Avec ça en tête, les chercheurs ont émis l'hypothèse que l'harmaline produite par les plantes doit être dégradée par les micro-organismes du sol environnant.
"Nous avons pu isoler la bactérie métabolisant l'harmaline Arthrobacter sp. C-4A du sol autour des racines de P. harmala, ", explique l'auteur principal de l'étude, Toshiki Nagakubo. "Par la suite, l'enzyme particulière impliquée dans la catalyse a été isolée des bactéries, et nous l'avons identifié comme cuivre amine oxydase. C'est la première fois qu'un lien est établi entre la cuivre amine oxydase et l'ouverture du cycle imine cyclique."
À la suite de leurs découvertes, les chercheurs ont proposé un mécanisme en deux étapes pour la rupture enzymatique de la double liaison carbone-azote propre aux composés imine. En plus d'identifier l'amine de cuivre oxydase comme catalyseur, l'équipe a pu montrer que la même enzyme isolée de différentes bactéries avait un effet similaire sur la dégradation. Étant donné le large éventail d'organismes, y compris les humains, qui produisent des alcaloïdes -carbolines, cet élargissement de la compréhension générale de la dégradation cyclique des imines a le potentiel d'avoir un impact sur de nombreux domaines de recherche.
"Nos résultats ajoutent une dimension intéressante aux connaissances actuelles sur les amines oxydases du cuivre, ", explique l'auteur correspondant de l'étude Michihiko Kobayashi. "Nous espérons que notre mécanisme et la transférabilité de nos observations permettront d'identifier d'autres processus physiologiques catalytiques et conduiront à des développements significatifs en pharmacologie."