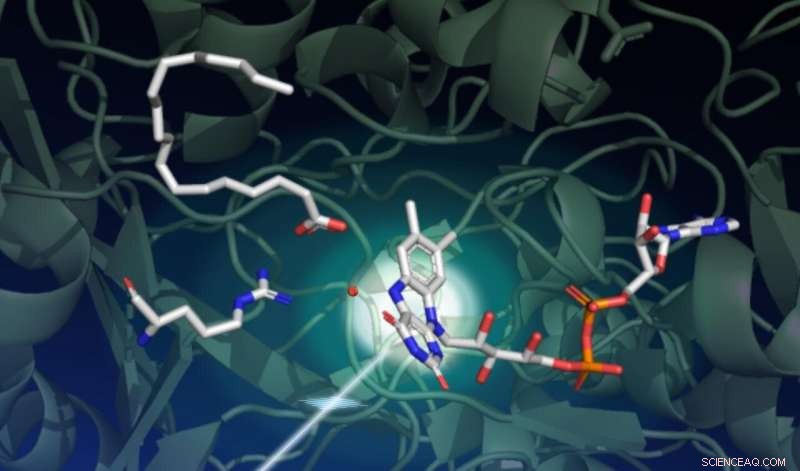
Une étude utilisant le laser à rayons X LCLS du SLAC a capturé comment la lumière entraîne une série de changements structurels complexes dans une enzyme appelée FAP, qui catalyse la transformation des acides gras en ingrédients de départ pour les solvants et les carburants. Ce dessin capture l'état de départ de la réaction catalytique. Le fond vert foncé représente l'échafaudage protéique. La partie photosensible de l'enzyme, appelé cofacteur FAD, est représenté au centre à droite avec ses trois anneaux absorbant un photon venant du bas à gauche. Un acide gras en haut à gauche attend la transformation. L'acide aminé montré au milieu à gauche joue un rôle important dans le cycle catalytique, et le point rouge près du centre est une molécule d'eau. Crédit :Damien Sorigue/Université Aix-Marseille
Bien que de nombreux organismes capturent et réagissent à la lumière du soleil, les enzymes, les protéines qui catalysent les réactions biochimiques, sont rarement entraînées par la lumière. Les scientifiques n'ont identifié jusqu'à présent que trois types de photoenzymes naturelles. Le plus récent, découvert en 2017, est la photodécarboxylase d'acide gras (FAP). Dérivé d'algues microscopiques, il utilise la lumière bleue pour catalyser la conversion des acides gras, trouvé dans les graisses et les huiles, en alcanes et alcènes.
« Un nombre croissant de laboratoires envisagent d'utiliser des FAP pour des applications de chimie verte, parce que les alcanes et les alcènes sont des composants importants des solvants et des carburants, y compris l'essence et les carburéacteurs. Et la transformation des acides gras en alcanes ou alcènes se fait en une seule étape au sein de l'enzyme, " dit Martin Weik, responsable d'un groupe de recherche à l'Institut de Biologie Structurale de l'Université Grenoble Alpes.
Weik est un chercheur principal d'une nouvelle étude qui a capturé la séquence complexe de changements structurels que subit la FAP en réponse à la lumière, appelé photocycle, qui entraîne cette transformation en acides gras. Bien que les chercheurs aient précédemment proposé un photocycle FAP, le mécanisme fondamental n'était pas compris. Les scientifiques ne savaient pas combien de temps il fallait à un acide gras pour perdre son carboxylate, le groupe chimique attaché à l'extrémité de sa longue chaîne d'hydrocarbures, une étape critique dans la formation d'alcènes ou d'alcanes.
En collaboration avec les scientifiques du SLAC, les expériences menées à la source de lumière cohérente Linac (LCLS) du laboratoire national de l'accélérateur SLAC du ministère de l'Énergie ont permis de répondre à bon nombre de ces questions en suspens. Les chercheurs décrivent leurs résultats dans Science .
Tous les outils dans une boîte à outils
Pour comprendre une enzyme photosensible comme la FAP, les scientifiques utilisent de nombreuses techniques différentes pour étudier les processus qui se déroulent sur une large gamme d'échelles de temps, car l'absorption des photons se produit en femtosecondes, ou des millionièmes de milliardième de seconde, tandis que les réponses biologiques au niveau moléculaire se produisent souvent en millièmes de seconde.
"Notre internationale, consortium interdisciplinaire, dirigé par Frédéric Beisson à l'Université Aix-Marseille, utilisé une multitude de techniques, y compris la spectroscopie, cristallographie et approches computationnelles, " C'est la somme de ces différents résultats qui nous a permis d'avoir un premier aperçu du fonctionnement de cette enzyme unique en fonction du temps et de l'espace", précise Weik.
Le consortium a d'abord étudié les étapes complexes du processus catalytique dans leurs laboratoires à l'aide de méthodes de spectroscopie optique, qui étudient la structure électronique et géométrique des atomes dans les échantillons, y compris la liaison chimique et la charge. Des expériences spectroscopiques ont identifié les états intermédiaires de l'enzyme accompagnant chaque étape, mesuré leur durée de vie et fourni des informations sur leur nature chimique. Ces résultats ont motivé le besoin des capacités ultrarapides du LCLS.
Prochain, une vue structurelle du processus catalytique a été fournie par cristallographie femtoseconde en série (SFX) avec le laser à électrons libres à rayons X LCLS (XFEL). Au cours de ces expériences, un jet de minuscules microcristaux FAP a été frappé avec des impulsions laser optiques pour lancer la réaction catalytique, suivi de très court, des impulsions de rayons X ultra-brillantes pour mesurer les changements résultants dans la structure de l'enzyme.
En intégrant des milliers de ces mesures, acquises à l'aide de divers délais entre les impulsions optiques et les impulsions de rayons X, les chercheurs ont pu suivre les changements structurels de l'enzyme au fil du temps. Ils ont également déterminé la structure de l'état de repos de l'enzyme en sondant sans laser optique.
Étonnamment, les chercheurs ont découvert qu'à l'état de repos, la partie photosensible de l'enzyme, appelé cofacteur FAD, a une forme courbée. "Ce cofacteur agit comme une antenne pour capturer les photons. Il absorbe la lumière bleue et initie le processus catalytique, " dit Weik. " Nous pensions que le point de départ du cofacteur FAD était planaire, donc cette configuration courbée était inattendue."
La forme courbée du cofacteur FAD a en fait été découverte pour la première fois par cristallographie aux rayons X à l'installation européenne de rayonnement synchrotron, mais les scientifiques soupçonnaient que ce virage était un artefact de dommages causés par les radiations, un problème courant pour les données cristallographiques collectées aux sources lumineuses synchrotron. Seules les expériences SFX ont pu confirmer cette configuration inhabituelle en raison de leur capacité unique à capturer des informations structurelles avant d'endommager l'échantillon, dit Weik.
"Ces expériences ont été complétées par des calculs, " il ajoute, "Sans les calculs quantiques de haut niveau effectués par Tatiana Domratcheva de l'Université d'État de Moscou, nous n'aurions pas compris nos résultats expérimentaux."
Prochaines étapes
Malgré une meilleure compréhension du photocycle de FAP, des questions sans réponses demeurent. Par exemple, les chercheurs savent que le dioxyde de carbone se forme au cours d'une certaine étape du processus catalytique à un moment et à un endroit précis, mais ils ne connaissent pas son état lorsqu'il quitte l'enzyme.
"Dans les futurs travaux XFEL, nous voulons identifier la nature des produits et prendre des photos du processus avec une taille de pas beaucoup plus petite afin de résoudre le processus de manière beaucoup plus fine, " dit Weik. " C'est important pour la recherche fondamentale, mais cela peut aussi aider les scientifiques à modifier l'enzyme pour effectuer une tâche pour une application spécifique. »